题目内容
【题目】由铜片、锌片和200mL 稀H2SO4组成的原电池中,若锌片只发生电化学反应,则当铜片上共放出3.36L(标准状况)气体时,H2SO4恰好完全消耗.求:
(1)反应中消耗的锌的质量是多少?(Zn:65)
(2)有多少个电子通过了导线?
(3)原稀H2SO4的物质的量浓度是多少?
【答案】
(1)解:由于锌比铜活泼,所以锌作负极,所以消耗的金属为锌.
锌失电子生成锌离子进入溶液,电极反应式为锌片:Zn﹣2e﹣=Zn 2+,铜片上氢离子得电子生成氢气,所以电极反应式为:铜片:2H++2e﹣=H2↑.
总反应:
Zn+ | 2H+ | = | H2↑+ | Zn 2+ |
65g | 22.4L | |||
9.75g | 3.36L |
所以消耗金属的质量为9.75g.
故答案为9.75g.
(2)解:
Zn+ | 2H+ | = | H2↑+ | Zn 2+ | 转移电子 |
22.4L | 2mol | ||||
3.36L | 0.3mol |
所以转移电子的物质的量为0.3mol,即1.806×1023个.
故答案为1.806×1023个.
(3)解:根据氢原子守恒,H+全部由H2SO4提供,
所以n(H2)=n(H2SO4)=0.15mol
c(H2SO4)= ![]() =0.75mol/L
=0.75mol/L
故答案为0.75mol/L.
【解析】(1)根据生成气体的量计算消耗的金属的量.(2)根据气体与转移电子之间的关系计算;(3)根据气体的物质的量计算消耗硫酸的物质的量,再根据物质的量浓度公式计算;

 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案【题目】800℃时,在2L的密闭容器中发生反应:2NO(g)+O2(g)2NO2 , n(NO)随时间的变化如表所示.
时间∕s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)∕mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)从0~3s内,用NO表示的平均反应速率v(NO)= .
(2)图中表示NO浓度变化的曲线是(填字母代号). 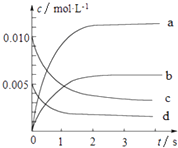
(3)达平衡时NO的转化率为 .
(4)能说明该反应已达到平衡状态的是(填序号). A.混合气体的颜色保持不变
B.混合气体的密度保持不变
C.v逆 (NO2)=2v正 (O2)
D.混合气体的平均相对分子质量保持不变
(5)若升温到850℃,达平衡后n(NO)=n(NO2),则反应向(填“正反应方向”“逆反应方向”)移动.
(6)若在一定条件下0.2molNO气体与氧气反应,达平衡时测得放出的热量为akJ,此时NO转化率为80%,则2molNO气体完全反应放出的热量为 .