题目内容
混合气体由N2和CH4组成,测得混合气体在标准状况下的密度为1.00g/L,则混合气体中N2和CH4的体积之比为( )
分析:根据M=ρVm计算混合气体的平均摩尔质量,根据十字交叉法计算混合气体中N2和CH4的体积比.
解答:解:混合气体在标准状况下的密度为1g/L,
则混合气体的平均摩尔质量为1g/L×22.4L/mol=22.4g/mol.
根据十字交叉法计算混合气体中N2和CH4的体积比:
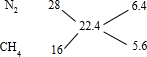
所以混合气体中N2和CH4的体积比为6.4:5.6=8:7,
故选D.
则混合气体的平均摩尔质量为1g/L×22.4L/mol=22.4g/mol.
根据十字交叉法计算混合气体中N2和CH4的体积比:

所以混合气体中N2和CH4的体积比为6.4:5.6=8:7,
故选D.
点评:本题考查混合物的计算,物质的量的有关计算等,难度中等,本题采取十字交叉法计算,简化计算.采取常见解法,容易理解,但计算繁琐,容易出错.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目