题目内容
混合气体由N2和CH4组成,测得混合气体在标准状况下的密度为0.821g/L,则混合气体中N2和CH4的体积比为( )
分析:根据M=ρVm计算混合气体的平均摩尔质量,根据十字交叉法计算混合气体中N2和CH4的体积比.
解答:解:混合气体在标准状况下的密度为0.821g/L,
则混合气体的平均摩尔质量为0.821g/L×22.4L/mol=18.4g/mol.
根据十字交叉法计算混合气体中N2和CH4的体积比:
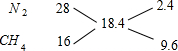
所以混合气体中N2和CH4的体积比为2.4:9.6=1:4.
故选B.
则混合气体的平均摩尔质量为0.821g/L×22.4L/mol=18.4g/mol.
根据十字交叉法计算混合气体中N2和CH4的体积比:
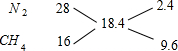
所以混合气体中N2和CH4的体积比为2.4:9.6=1:4.
故选B.
点评:本题考查混合物的计算,难度中等,本题采取十字交叉法计算,简化计算.采取常见解法,容易理解,但计算繁琐,容易出错.

练习册系列答案
相关题目