题目内容
下列离子方程式书写正确是
| A.向碳酸氢钙溶液中加入过量的氢氧化钠溶液:Ca2++HCO3—+OH-=CaCO3↓+H2O |
| B.将少量氯化铁溶液滴入硫化钠溶液中:2Fe3++S2-=2Fe2++S↓ |
| C.次氯酸钙溶液中通入过量二氧化碳:Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO |
| D.氯化亚铁溶液中加入稀硝酸:9Fe2++4H++NO3-=9Fe3++2H2O+NO↑ |
D
解析试题分析:判断离子方程式正确与否的方法一般是:(1)检查反应能否发生。(2)检查反应物、生成物是否正确。(3)检查各物质拆分是否正确。(4)检查是否符合守恒关系(如:质量守恒和电荷守恒等)。(5)检查是否符合原化学方程式。A、向碳酸氢钙溶液中加入过量的氢氧化钠溶液生成碳酸钙、碳酸钠和水,因此反应的离子方程式为Ca2++2HCO3—+2OH-=CaCO3↓+H2O+CO32-,A不正确;B、将少量氯化铁溶液滴入硫化钠溶液中生成单质S、FeS沉淀,离子方程式为2Fe3++2S2-=FeS+S↓+Fe2+,B不正确;C、次氯酸钙溶液中通入过量二氧化碳生成碳酸氢钙、次氯酸,反应的离子方程式为ClO-+H2O+CO2=HCO3-↓+HClO,C不正确;D、氯化亚铁溶液中加入稀硝酸发生氧化还原反应,反应的离子方程式为9Fe2++4H++NO3-=9Fe3++2H2O+NO↑,D正确,答案选D。
考点:考查离子共存的正误判断

 阶梯计算系列答案
阶梯计算系列答案某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe3+、Al3+和K+。取该溶液100mL,加入过量NaOH溶液,加热,得到0.02mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得到1.6g固体;向上述滤液中加足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀。有关原溶液中下列说法不正确的是:
| A.至少存在4种离子 |
| B.Cl-一定存在,且c(Cl-)≥0.4mol/L |
| C.SO42-、NH4+、Fe3+一定存在,Al3+、K+、Cl-可能存在 |
| D.CO32-一定不存在,SO42-、NH4+、Fe3+、Cl-一定存在 |
下列表示正确的是( )
| A.用碳酸钠溶液吸收少量二氧化硫: 2CO32-+SO2+H2O =2HCO3-+SO32- |
B.CO(g)的燃烧热是283.0kJ· ,则 ,则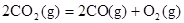 反应的 反应的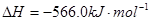 |
C.含有大量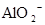 的溶液中:K+、 的溶液中:K+、 、 、 、 、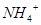 可共存 可共存 |
D.在某钠盐溶液中含有等物质的量的 、 、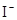 、 、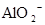 、 、 、 、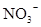 、 、 中若干种,当加入过量的盐酸产生气泡,溶液颜色变深,阴离子种数减少3种,则原溶液中一定有 中若干种,当加入过量的盐酸产生气泡,溶液颜色变深,阴离子种数减少3种,则原溶液中一定有 |
在水溶液中能大量共存的一组离子是( )
| A.Na+ Cl- NO3- H+ | B.Na+ Cu2+ Cl- S2- |
| C.K+ SO32- Fe3+ NO3- | D.K+ NH4+ SiO32- SO42- |
下列叙述正确的是( )
| A.蒸馏时,应使温度计水银球应插入蒸馏烧瓶液体中 |
| B.NH3溶于水能导电所以NH3是电解质 |
| C.含有Mg2+、Cu2+、Fe2+和Na+的四种氯化物溶液,只用NaOH溶液不能鉴别开 |
| D.标准状况下4.48 L CO2气体通过足量的Na2O2固体经充分反应,剩余气体在相同条件下的体积是2.24 L |
下列属于电解质并能导电的物质是
| A.淀粉 | B.KNO3溶液 | C.FeCl3晶体 | D.熔融的NaCl |
对溶液中的离子反应存在下列几种说法,其中正确的是
| A.不可能是氧化还原反应 | B.只能是复分解反应 |
| C.可能是化合反应 | D.不可能是置换反应 |
某同学为检验溶液中是否含有常见的四种无机离子,进行了下图所示的实验操作。其中检验过程中产生的气体能使湿润的红色石蕊试纸变蓝。由该实验能得到的正确结论是( )
| A.原溶液中一定含有SO42-离子 | B.原溶液中一定含有NH4+离子 |
| C.原溶液中一定含有Cl-离子 | D.原溶液中一定含有Fe3+离子 |
下列表示对应化学反应的离子方程式正确的是:
| A.玻璃试剂瓶被烧碱溶液腐蚀:SiO2+2Na++2OH-=Na2SiO3↓+H2O |
| B.硫酸亚铁溶液被空气中氧气氧化:4Fe2+ +O2+4H+=4Fe3+ +2H2O |
| C.向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- |
| D.用食醋和淀粉-KI试纸检验碘盐中的KIO3IO3-+5I-+6H+=3I2+3H2O |