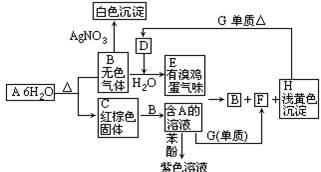
题目内容
(11分) 甲、乙、丙、丁四种单质在点燃条件下两两化合生成X、Y、Z、W四种化合物,转化关系如右图所示。
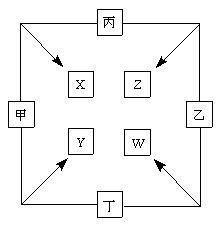
已知:
① 甲、乙、丙均为前三周期元素的单质,常温下均为气体,丁是日常生活中的一种常见金属。
② 常温下,X是无色液体,Y是黑色固体。
③ 丙在乙中燃烧发出苍白色的 火焰,W的水溶液呈黄色。
火焰,W的水溶液呈黄色。
请回答:
(1)写化学式:甲_____________, Z_____________。
(2)丁与X在高温下也能得到Y,请写出该反应的化学方程式
___________________________________________________。
(3)将少量W的溶液滴入几滴KSCN溶液,迅速变为红色,请写出该反应的化学方程式____________________________________________________。
(4)甲与丙两单质的元素可形成原子个数比1∶1的化合物H,将H滴入品红后,溶液的颜色逐渐褪去,加热后溶液为 (填颜色)。
(5)将Y恰好溶于Z的水溶液后,检验其中低价金属离子的方法是滴入酸性KMnO4,紫色褪去,说明有该离子,仔细分析后发现该结论存在缺陷,此“缺陷”是 。

已知:
① 甲、乙、丙均为前三周期元素的单质,常温下均为气体,丁是日常生活中的一种常见金属。
② 常温下,X是无色液体,Y是黑色固体。
③ 丙在乙中燃烧发出苍白色的
 火焰,W的水溶液呈黄色。
火焰,W的水溶液呈黄色。请回答:
(1)写化学式:甲_____________, Z_____________。
(2)丁与X在高温下也能得到Y,请写出该反应的化学方程式
___________________________________________________。
(3)将少量W的溶液滴入几滴KSCN溶液,迅速变为红色,请写出该反应的化学方程式____________________________________________________。
(4)甲与丙两单质的元素可形成原子个数比1∶1的化合物H,将H滴入品红后,溶液的颜色逐渐褪去,加热后溶液为 (填颜色)。
(5)将Y恰好溶于Z的水溶液后,检验其中低价金属离子的方法是滴入酸性KMnO4,紫色褪去,说明有该离子,仔细分析后发现该结论存在缺陷,此“缺陷”是 。
(1) O2,HCl (2) 3Fe + 4H2O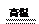 Fe3O4 + 4H2
Fe3O4 + 4H2
(3) Fe3++ 3SCN-= Fe(SCN)3 (4) 无色
(5) 在酸性条件下,Cl-也能将MnO4-还原,使其褪色
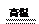 Fe3O4 + 4H2
Fe3O4 + 4H2(3) Fe3++ 3SCN-= Fe(SCN)3 (4) 无色
(5) 在酸性条件下,Cl-也能将MnO4-还原,使其褪色
(1)无机推断题,要找准“题眼”,本题中③可作为切入点,丙在乙中燃烧发出苍白色的 火焰,我们很容易推断,丙为H2,乙为Cl2,Z为HCl;W的水溶液呈黄色,则含有Fe3+,W为FeCl3,推丁为金属Fe;常温下,X是无色液体,X为H2O,则甲为O2,Y为Fe3O4
火焰,我们很容易推断,丙为H2,乙为Cl2,Z为HCl;W的水溶液呈黄色,则含有Fe3+,W为FeCl3,推丁为金属Fe;常温下,X是无色液体,X为H2O,则甲为O2,Y为Fe3O4
(2)丁与X在高温下也能得到Y的化学方程式为3Fe + 4H2O Fe3O4 + 4H2
Fe3O4 + 4H2
(3)Fe3+遇SCN-显红色,可以用来检验Fe3+,离子方程式为Fe3++ 3SCN-= Fe(SCN)3。
(4)甲与丙两单质的元素可形成原子个数比1∶1的化合物H2O2,H2O2具有强氧化性,能使品红褪色,加热,不能恢复,所以溶液最终无色。
(5)酸性KMnO4可以氧化Fe2+,同时也能氧化Cl-。所以酸性KMnO4紫色褪去,不能验证溶液中一定存在Fe2+。
 火焰,我们很容易推断,丙为H2,乙为Cl2,Z为HCl;W的水溶液呈黄色,则含有Fe3+,W为FeCl3,推丁为金属Fe;常温下,X是无色液体,X为H2O,则甲为O2,Y为Fe3O4
火焰,我们很容易推断,丙为H2,乙为Cl2,Z为HCl;W的水溶液呈黄色,则含有Fe3+,W为FeCl3,推丁为金属Fe;常温下,X是无色液体,X为H2O,则甲为O2,Y为Fe3O4(2)丁与X在高温下也能得到Y的化学方程式为3Fe + 4H2O
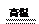 Fe3O4 + 4H2
Fe3O4 + 4H2(3)Fe3+遇SCN-显红色,可以用来检验Fe3+,离子方程式为Fe3++ 3SCN-= Fe(SCN)3。
(4)甲与丙两单质的元素可形成原子个数比1∶1的化合物H2O2,H2O2具有强氧化性,能使品红褪色,加热,不能恢复,所以溶液最终无色。
(5)酸性KMnO4可以氧化Fe2+,同时也能氧化Cl-。所以酸性KMnO4紫色褪去,不能验证溶液中一定存在Fe2+。

练习册系列答案
相关题目

 (2)写出B、C 的最高价氧化物对应的水化物间反
(2)写出B、C 的最高价氧化物对应的水化物间反