题目内容
【题目】(1)下列Li原子电子排布图表示的状态中,电离最外层一个电子所需能量最小的是_______(填标号)。
A.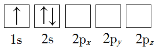 B.
B.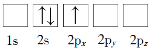
C.![]() D.
D.![]()
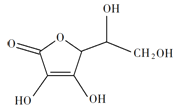
(2)抗坏血酸的分子结构如图所示,分子中碳原子的轨道杂化类型为______;推测抗坏血酸在水中的溶解性:_______(填“难溶于水”或“易溶于水”)。
(3)下表列有三种物质(晶体)的熔点:
物质 | SiO2 | SiCl4 | SiF4 |
熔点℃ | 1710 | -70.4 | -90.2 |
简要解释熔点产生差异的原因:_______。
(4)磷化硼(BP)是一种超硬耐磨涂层材料,如图为其晶胞,晶胞边长为anm。则硼原子与磷原子最近的距离为_______。用Mg·mol-1表示磷化硼的摩尔质量,NA表示阿伏加德罗常数的值,则磷化硼晶体的密度为_______g·cm-3。
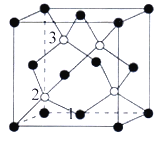
以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图中原子1的坐标为(![]() ,
,![]() ,0),则原子2和3的坐标分别为_______、______。
,0),则原子2和3的坐标分别为_______、______。
【答案】D sp3、sp2 易溶于水 SiO2是原子晶体,微粒间作用力为共价键。SiCl4是分子晶体,微粒间作用力为范德华力,故SiO2熔点高于SiCl4和SiF4。SiCl4和SiF4均为分子晶体,微粒间作用力为范德华力,结构相似时相对分子质量越大,范德华力越大,故SiCl4熔点高于SiF4 ![]() nm
nm 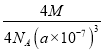 (
(![]() ,
,![]() ,
,![]() ) (
) (![]() ,
,![]() ,
,![]() )
)
【解析】
(1)原子核外电子排布中,如果电子所占的轨道能级越低,该原子的能量越低;
(2)根据分子中C原子的价层电子对个数,结合价层电子对互斥理论判断该分子中C原子轨道杂化类型;抗坏血酸中羟基属于亲水基,增大其水解性;
(3)根据构成微粒的作用力大小分析、比较;
(4)晶体中硼原子与磷原子最近的距离为晶胞体对角线的![]() ,根据晶体密度与摩尔质量换算关系计算
,根据晶体密度与摩尔质量换算关系计算![]() ;根据图中各个原子的相对位置确定2、3号原子的坐标。
;根据图中各个原子的相对位置确定2、3号原子的坐标。
(1)原子核外电子排布中,如果电子所占的轨道能级越低,该原子的能量越低。根据图知,电子排布能量最低的是1s、2s能级,所以合理选项是D;
(2) 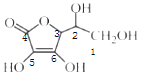 中1、2、3号C原子价层电子对个数是4,4、5、6号碳原子价层电子对个数是3,根据价层电子对互斥理论判断该分子中C原子轨道杂化类型,1、2、3号C原子采用sp3杂化,4、5、6号C原子采用sp2杂化;抗坏血酸中羟基属于亲水基,增大其水解性,所以抗坏血酸易溶于水;
中1、2、3号C原子价层电子对个数是4,4、5、6号碳原子价层电子对个数是3,根据价层电子对互斥理论判断该分子中C原子轨道杂化类型,1、2、3号C原子采用sp3杂化,4、5、6号C原子采用sp2杂化;抗坏血酸中羟基属于亲水基,增大其水解性,所以抗坏血酸易溶于水;
(3)SiO2是原子晶体,原子间以极强的共价键结合,断裂消耗很高的能量,而SiCl4、SiF4都是由分子通过分子间作用力结合形成的分子晶体,分子间作用力非常微弱,所以SiO2熔点高于SiCl4和SiF4。对于由分子构成的分子晶体,若物质结构相似,相对分子质量越大,分子间作用力就越大,物质的熔沸点就越高,所以SiCl4熔点高于SiF4;
(4)BP晶体中晶胞参数是anm,晶胞的对角线长度为L=![]() ,根据晶胞结构可知:在晶体中硼原子与磷原子晶胞体对角线的
,根据晶胞结构可知:在晶体中硼原子与磷原子晶胞体对角线的![]() ,因此二者的最近的距离为
,因此二者的最近的距离为![]() nm。在一个晶胞中含有B、P原子个数为P:
nm。在一个晶胞中含有B、P原子个数为P:![]() =4;含有的B原子数目为4个,所以一个晶胞中含有4个BP,用Mg·mol-1表示磷化硼的摩尔质量,NA表示阿伏加德罗常数的值,则磷化硼晶体的密度
=4;含有的B原子数目为4个,所以一个晶胞中含有4个BP,用Mg·mol-1表示磷化硼的摩尔质量,NA表示阿伏加德罗常数的值,则磷化硼晶体的密度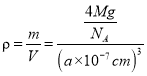 =
=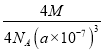 g/cm3
g/cm3![]() ,
,![]() ,0),则原子2的坐标为(
,0),则原子2的坐标为(![]() ,
,![]() ,
,![]() ),原子3的坐标为(
),原子3的坐标为(![]() ,
,![]() ,
,![]() )。
)。

【题目】下表是元素周期表的一部分,请回答有关问题:
主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
二 | ① | ② | ||||||
三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
四 | ⑨ | ⑩ |
(1)表中化学性质最不活泼的元素是______。(用元素符号表示)
(2)②③④三种元素的原子半径从大到小的顺序是______(用元素符号表示)
(3)用电子式表示③与⑦形成化合物的过程_______________________。
(4)在①~⑧元素中,元素的最高价氧化物对应的水化物中碱性最强的___。(填化学式)
(5)在⑦与⑩的单质中,化学性质较活泼的是_____。(填化学式)