题目内容
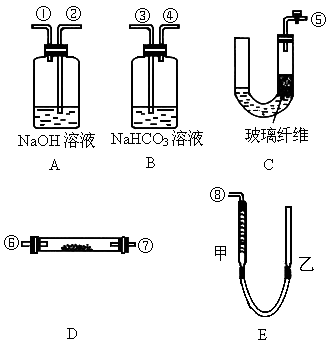
过氧化钠与二氧化碳反应的化学方程式为2Na2O2+2CO2![]() 2Na2CO3+O2.某学生为了验证这一实验,以足量的大理石、足量的盐酸和1.95 g过氧化钠样品为原料,制取O2,设计出如下实验装置:
2Na2CO3+O2.某学生为了验证这一实验,以足量的大理石、足量的盐酸和1.95 g过氧化钠样品为原料,制取O2,设计出如下实验装置:

(1)A中制取CO2的装置,应从下列图①②③中选哪个图:________.

B装置的作用是________,C装置内可能出现的现象是________.为了检验E中收集到的气体,在取出集气瓶后,用________的木条伸入集气瓶内,木条________.
(2)若E中的石灰水出现轻微白色浑浊,请说明原因:________.
(3)若D中的1.95 g过氧化钠样品接近反应完毕时,你预测E装置内有何现象?
______________________________________________.
(4)反应完毕时,若测得E中的集气瓶收集到的气体为250 mL,又知氧气的密度为1.43 g·L-1,在装置的气密性良好的情况下,实际收集到的氧气体积比理论计算值________(填“大”或“小”),相差约________mL(取整数值,所用数据均在标准状况下测定),这是由于________.
答案:
解析:
解析:
|
(1)② 除去CO2中的HCl 可能会由白变蓝 带火星 会复燃 (2)有一些CO2没反应,进入到E中 (3)①E内产生大量白色沉淀;②E内液面不再下降 (4)小 30 Na2O2中有杂质 |

练习册系列答案
相关题目