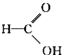
题目内容
【题目】(1)0.3 mol NH3分子中所含原子数与________个H2O分子中所含原子数相等。
(2)含有0.4 mol Al3+的Al2(SO4)3溶液中所含SO42-的物质的量是________。
【答案】2.408×1023 0.6 mol
【解析】
(1)依据微粒数之比等于物质的量之比,结合![]() 计算;
计算;
(2)1mol硫酸铝电离产生3mol硫酸根离子、2mol铝离子。
(1)0.3mol NH3中所含原子物质的量为1.2mol;原子数之比等于物质的量之比,H2O分子中所含原子数也为1.2mol,需水0.4mol,由![]() 可知H2O分子个数为0.4×6.02×1023=2.408×1023,故答案为:2.408×1023;
可知H2O分子个数为0.4×6.02×1023=2.408×1023,故答案为:2.408×1023;
(2)硫酸铝的电离方程为:Al2(SO4)3=2Al3++3SO42-,1mol硫酸铝电离产生3mol硫酸根离子、2mol铝离子两者之比为2:3,所以含有0.4mol Al3+的Al2(SO4)3溶液中所含SO42-:![]() 故答案为:0.6mol。
故答案为:0.6mol。

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案
相关题目