题目内容
密闭容器中,反应xA(g)+yB(g)?zC(g)达平衡时,A的浓度为0.5mol?L-1,若保持温度不变,将容器的容积扩大到原来的2倍,达新平衡时A的浓度降为0.2mol?L-1.下列判断正确的是( )
分析:温度不变,将容器的容积扩大到原来的2倍,若平衡不移动,则A的浓度变为0.25mol/L,由达新平衡时A的浓度降为0.2mol?L-1<0.25mol?L-1,则体积增大相当于压强减小时,平衡正向移动,以此来解答.
解答:解:温度不变,将容器的容积扩大到原来的2倍,若平衡不移动,则A的浓度变为0.25mol/L,由达新平衡时A的浓度降为0.2mol?L-1<0.25mol?L-1,则体积增大相当于压强减小时,平衡正向移动,
A.压强减小,平衡正向移动,所以x+y<z,故A正确;
B.由分析可知,化学平衡正向移动,故B错误;
C.化学平衡正向移动,B的转化率增大,故C错误;
D.化学平衡正向移动,生成C的物质的量增大,所以C的体积分数增大,故D错误;
故选A.
A.压强减小,平衡正向移动,所以x+y<z,故A正确;
B.由分析可知,化学平衡正向移动,故B错误;
C.化学平衡正向移动,B的转化率增大,故C错误;
D.化学平衡正向移动,生成C的物质的量增大,所以C的体积分数增大,故D错误;
故选A.
点评:本题考查化学平衡计算及化学平衡移动,明确体积变化引起A的浓度变化是解答本题的关键,注意动态变化与静态变化相结合得出平衡正向移动即可解答,题目难度不大.

练习册系列答案
 一课一练课时达标系列答案
一课一练课时达标系列答案
相关题目

 zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系。则下列结论正确的是
zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系。则下列结论正确的是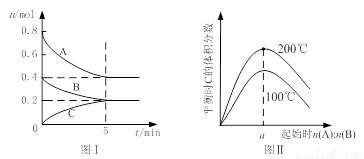
 zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系。则下列结论正确的是
zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系。则下列结论正确的是