题目内容
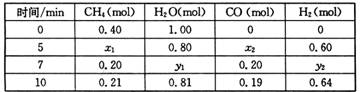
在体积为2 L的恒容密闭容器中发生反应xA(g)+yB(g) zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系。则下列结论正确的是
zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系。则下列结论正确的是
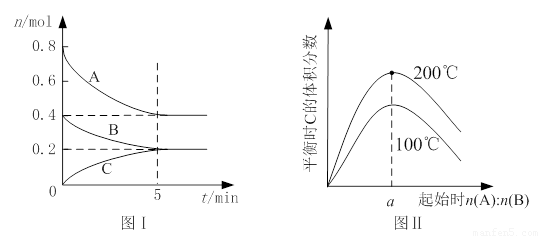
A.200℃时,反应从开始到平衡的平均速率v(B)=" 0." 02 mol·L-1·min-1
B.图Ⅱ所知反应xA(g)+yB(g) zC(g)的△H<0,且a=2
zC(g)的△H<0,且a=2
C.若在图Ⅰ所示的平衡状态下,再向体系中充入He,重新达到平衡前v(正)>v(逆)
D.200℃时,向容器中充入2 mol A 和1 mol B,达到平衡时,A 的体积分数小于0.5
AD
【解析】
试题分析:根据图1可知,平衡时B的物质的量减少了0.4mol-0.2mol=0.2mol,所以用物质B表示的反应速率是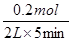 =0. 02 mol·L-1·min-1,A正确;题意根据图1可知,平衡时A的物质的量减少了0.4mol,C的物质的量增加了0.2mol,所以该反应的化学方程式是2A(g)+B(g)
=0. 02 mol·L-1·min-1,A正确;题意根据图1可知,平衡时A的物质的量减少了0.4mol,C的物质的量增加了0.2mol,所以该反应的化学方程式是2A(g)+B(g) C(g)。根据图2可知,温度越高,C的含量越高,这说明升高温度平衡向正反应方向移动,则正方应是吸热反应,B不正确;容器容积不变,则再向体系中充入He,体系压强增大,但,反应速率不变,平衡不移动,C不正确;D中200℃时,向容器中充入2 mol A 和1 mol B,相当于是在原平衡的基础上增大压强,平衡向正反应方向移动,所以反应物A的转化率增大,含量降低,D正确,答案选AD。
C(g)。根据图2可知,温度越高,C的含量越高,这说明升高温度平衡向正反应方向移动,则正方应是吸热反应,B不正确;容器容积不变,则再向体系中充入He,体系压强增大,但,反应速率不变,平衡不移动,C不正确;D中200℃时,向容器中充入2 mol A 和1 mol B,相当于是在原平衡的基础上增大压强,平衡向正反应方向移动,所以反应物A的转化率增大,含量降低,D正确,答案选AD。
考点:考查反应速率的计算、外界条件对平衡状态的影响以及图像识别等
点评:该题是高考中的常见题型,属于综合性试题的考查,侧重对学生解题能力的培养,旨在培养学生分析、归纳、总结问题的能力。有利于调动学生的学习兴趣和学习积极性,也有助于培养学生的逻辑推理能力和抽象思维能力。

(10分)已知几种共价键的键能数据如下:
| 共价键 | N≡N | H-H | N-H |
| 键能/(kJ·mol-1) | 946 | 436 | 390.8 |
⑵某温度下,以1 mol N2和3mol H2作为初始反应物,在体积为2 L的恒容密闭容器中进行合成氨反应,达到平衡时测得反应放热68.1 kJ,试计算N2的转化率和该温度下的化学平衡常数。
 CO(g)+3H2(g) △H>0,一定温度下,在体积为2 L的恒容容器中发生上述反应,各物质的物质的量变化如下表:
CO(g)+3H2(g) △H>0,一定温度下,在体积为2 L的恒容容器中发生上述反应,各物质的物质的量变化如下表: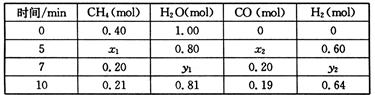
 zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系。则下列结论正确的是
zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系。则下列结论正确的是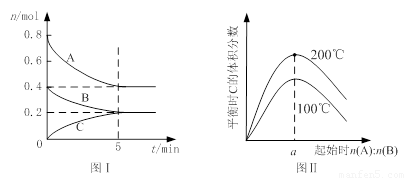
 zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系。则下列结论正确的是
zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系。则下列结论正确的是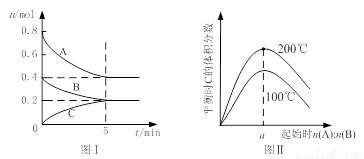
 CO(g)+3H2(g) △H>0,一定温度下,在体积为2 L的恒容容器中发生上述反应,各物质的物质的量变化如下表:
CO(g)+3H2(g) △H>0,一定温度下,在体积为2 L的恒容容器中发生上述反应,各物质的物质的量变化如下表: