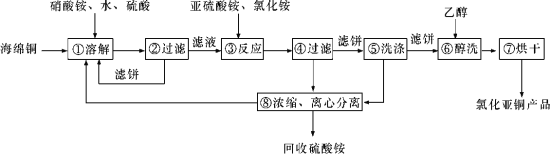
题目内容
【题目】(1)用电子式表示H2O和MgBr2的形成过程:
H2O__;MgBr2__;
(2)写出CO2、Na2O2、H2O2的电子式:
CO2_;Na2O2__;H2O2___。
【答案】![]()
![]()
![]()
![]()
![]()
【解析】
H2O、CO2、H2O2为共价化合物;溴化镁为离子化合物,构成微粒为镁离子和溴离子;Na2O2为离子化合物。
(1)H2O为共价化合物,分子中氢原子与氧原子之间形成1对共用电子对,用电子式表示形成过程为![]() ;溴化镁是离子化合物,由钠离子与镁离子构成,用电子式表示的形成过程为
;溴化镁是离子化合物,由钠离子与镁离子构成,用电子式表示的形成过程为![]() 。
。
(2)二氧化碳中存在两对碳氧共用电子对,二氧化碳的电子式为:![]() ; Na2O2是钠离子和过氧根离子构成的离子化合物,钠离子失电子形成阳离子,氧原子得到电子形成过氧根阴离子,电子式为
; Na2O2是钠离子和过氧根离子构成的离子化合物,钠离子失电子形成阳离子,氧原子得到电子形成过氧根阴离子,电子式为![]() ;双氧水为共价化合物,分子中存在两个氧氢键和一个O-O键,双氧水的电子式为:
;双氧水为共价化合物,分子中存在两个氧氢键和一个O-O键,双氧水的电子式为:![]() 。
。

 备战中考寒假系列答案
备战中考寒假系列答案【题目】碳和氮的化合物在生产生活中广泛存在。回答下列问题:
(1)催化转化器可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染。
已知:N2(g)+O2(g)=2NO(g) △H1=+180.5 kJ/mol;
2C(s)+O2(g)=2CO(g) △H2=-221.0 kJ/mol;
C(s)+O2(g)=CO2(g) △H3=-393.5 kJ/mol
则尾气转化反应2NO(g) +2CO(g)=N2(g)+2CO2(g)的△H=___________。
(2)氨是一种重要的化工原料,在工农业生产中有广泛的应用。在773 K时,分别将2.00 mol N2和6.00 mol H2充入一个固定容积为1 L的密闭容器中,随着反应的进行,气体混合物中n(H2)、n(NH3)与反应时间(t)的关系如表所示:
t/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
n(H2)/mol | 6.00 | 4.50 | 3.60 | 3.30 | 3.03 | 3.00 | 3.00 |
n(NH3)/mol | 0 | 1.00 | 1.60 | 1.80 | 1.98 | 2.00 | 2.00 |
①该温度下,若向同容积的另一容器中投入N2、H2、NH3,其浓度均为3 mol/L,则此时v正____v逆(填“大于”“小于”或“等于”)。
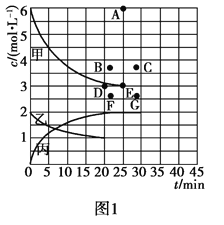
②由表中的实验数据可得到“c—t”的关系,如图1所示,表示c(N2)—t的曲线是______。在此温度下,若起始充入4 mol N2和12 mol H2,则反应刚达到平衡时,表示c(H2)—t的曲线上相应的点为________。
![]() N2(g)+CO2(g) △H=-34.0kJ/mol,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图2所示:
N2(g)+CO2(g) △H=-34.0kJ/mol,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图2所示:
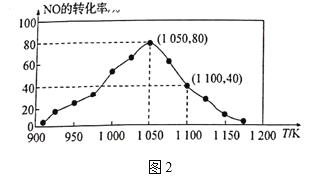
①由图可知,1050K前反应中NO的转化率随温度升髙而增大,其原因为_______;在1100K时,CO2的体积分数为__________。
②用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在1050K、1.1×106Pa时,该反应的化学平衡常数Kp=______[已知:气体分压(P分)=气体总压(Pa)×体积分数]。
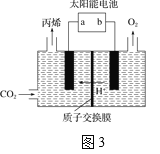
(4)在酸性电解质溶液中,以惰性材料作电极,将CO2转化为丙烯的原理如图3所示
①太阳能电池的负极是_______(填“a”或“b”)
②生成丙烯的电极反应式是___________。
【题目】BaCl2可用于电子、仪表等工业。以毒重石(主要成分为BaCO3,含少量的CaCO3、MgSO4、Fe2O3、SiO2等杂质)为原料,模拟工业制取BaCl2·2H2O的流程如下图所示:

已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9。
Ca2+ | Mg2+ | Fe3+ | |
开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的pH | 13.9 | 11.0 | 3.7 |
(1)盐酸浸取时需要适当加热的原因是_____。
(2)滤渣Ⅰ的成分为_____。
(3)加入H2C2O4时应避免过量,其原因是_____。
(4)用37%的盐酸配制15%的盐酸需用到的仪器有_____(填字母)。
A.量筒 B.烧杯 C.容量瓶 D.玻璃棒
(5)滤渣Ⅲ需经过洗涤后才能进行后续加工处理的原因是_____。
(6)请补充完整由碳酸钡石(含30%CaCO3的BaCO3矿石)模拟工业制取BaCl2·2H2O的实验步骤为_____,过滤,用无水乙醇洗涤2~3次,低温干燥。(实验中可使用的试剂有:冷水,80℃热水,0.1mol·L-1盐酸,6mol·L-1盐酸)