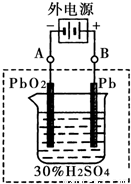
题目内容
(1)铅蓄电池的电池总反应式为:
Pb+PbO2+4H++2SO42- ![]() 2PbSO4+2H2O回答下列
2PbSO4+2H2O回答下列
 |
问题。(不考虑氢、氧的氧化还原)
①放电时:负极的电极反应式是 ,
电解液中H2SO4的浓度将变________,当外电路通过
2mol电子时,理论上负极板的质量增加 g。
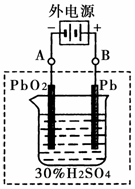
②在完全放电耗尽PbO2和Pb时,将原Pb和PbO2极板
按右图连接,电解一段时间后,则在A电极上生成 __________,B电极上?生成________。
(2)三氧化二镍(Ni2O3)可用于制造高能电池,其电解法制备过程如下:用NaOH调NiCl2溶液pH至7.5,加放适量硫酸钠后进行电解。电解过程中产生的Cl2在弱碱性条件下生成ClO-,把二价镍氧化为三价镍。以下说法正确的是
a.可用铁作阳极材料
b.电解过程中阳极附近溶液的pH升高
c.阳极反应方程式为:2Cl--2e-=Cl2↑
d.1 mol二价镍全部转化为三价镍时,外电路中通过了1mol电子。
(1)①Pb+SO42- -2e- = PbSO4 (2分)
小(1分) 96 (2分)
②Pb;(1分) PbO2 ;(1分)
(2)cd(2分)

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
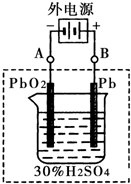 (1)铅蓄电池的电池总反应式为:
(1)铅蓄电池的电池总反应式为: 2PbSO4+2H2O回答下列 问题。(不考虑氢、氧的氧化还原)
2PbSO4+2H2O回答下列 问题。(不考虑氢、氧的氧化还原)
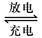 2PbSO4+2H2O回答下列
问题。(不考虑氢、氧的氧化还原)
2PbSO4+2H2O回答下列
问题。(不考虑氢、氧的氧化还原)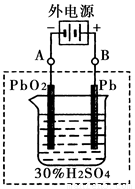
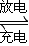 2PbSO4+2H2O回答下列问题.(不考虑氢、氧的氧化还原)
2PbSO4+2H2O回答下列问题.(不考虑氢、氧的氧化还原)