题目内容
将等物质的量的F2和ClF混合,在密闭容器中发生反应:F2(g)+ClF(g) 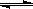 ClF3(g) ΔH<0。下列叙述正确的是
ClF3(g) ΔH<0。下列叙述正确的是
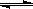 ClF3(g) ΔH<0。下列叙述正确的是
ClF3(g) ΔH<0。下列叙述正确的是| A.保持恒容,平衡后再降低温度,平衡常数减小 |
| B.若增加F2的用量,平衡正向移动,则反应物的转化率均增大 |
| C.达到平衡后,若增大容器体积,则正反应速率减小,逆反应速率增大,平衡左移 |
| D.恒温恒容时,当ClF转化40%时,容器内的压强为初始时的0.8 |
D
试题分析:A、正方应是放热反应,则保持恒容,平衡后再降低温度,平衡向正反应方向移动,因此平衡常数增大,A不正确;B、若增加F2的用量,平衡正向移动,ClF的转化率增大,但单质氟的转化率降低,B不正确;C、正方应是体积减小的可逆反应,达到平衡后,若增大容器体积,越强降低,则正反应速率和逆反应均减小,平衡左移,C不正确;D、恒温恒容时,当ClF转化40%时,则
F2(g)+ClF(g)
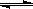 ClF3(g)
ClF3(g)起始量(mol) n n 0
转化量(mol) 0.4n 0.4n 0.4n
平衡量(mol) 0.6n 0.6n 0.4n
所以容器内的压强为初始时的
 =0.8倍,D正确,答案选D。
=0.8倍,D正确,答案选D。
练习册系列答案
相关题目
 2Z反应达到平衡,在升高温度或减小压强的情况下,平衡均向右移动,则下列有关反应的各种叙述中正确的是
2Z反应达到平衡,在升高温度或减小压强的情况下,平衡均向右移动,则下列有关反应的各种叙述中正确的是  2Z(g);△H<0,达到平衡时,下列说法正确的是:
2Z(g);△H<0,达到平衡时,下列说法正确的是:
 3C(g)+D(g),达到平衡时,C的浓度为W mol/L,若维持容器体积和温度不变,按下列四种方法改变起始物质,达到平衡后,C的浓度仍为Wmol/L的是
3C(g)+D(g),达到平衡时,C的浓度为W mol/L,若维持容器体积和温度不变,按下列四种方法改变起始物质,达到平衡后,C的浓度仍为Wmol/L的是 PCl5(g)达平衡时,PCl5为0.40 mol,如果此时移走1.0 mol PCl3和0.50 mol Cl2,在相同温度下再达平衡时PCl5的物质的量是( )
PCl5(g)达平衡时,PCl5为0.40 mol,如果此时移走1.0 mol PCl3和0.50 mol Cl2,在相同温度下再达平衡时PCl5的物质的量是( )  2NH3的平衡常数K=a,则此温度下,NH3
2NH3的平衡常数K=a,则此温度下,NH3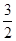 H2+
H2+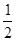 N2的平衡常数为( )
N2的平衡常数为( )