题目内容
某温度时,反应N2+3H2 2NH3的平衡常数K=a,则此温度下,NH3
2NH3的平衡常数K=a,则此温度下,NH3
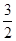 H2+
H2+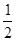 N2的平衡常数为( )
N2的平衡常数为( )
 2NH3的平衡常数K=a,则此温度下,NH3
2NH3的平衡常数K=a,则此温度下,NH3
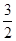 H2+
H2+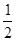 N2的平衡常数为( )
N2的平衡常数为( )| A.a-1/2 | B.a1/2 | C.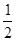 a a | D.a-2 |
A
试题分析:
NH3

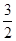 H2+
H2+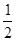 N2的平衡常数为:
N2的平衡常数为: ,因此,选A。
,因此,选A。
练习册系列答案
相关题目
题目内容
 2NH3的平衡常数K=a,则此温度下,NH3
2NH3的平衡常数K=a,则此温度下,NH3
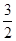 H2+
H2+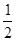 N2的平衡常数为( )
N2的平衡常数为( )| A.a-1/2 | B.a1/2 | C.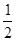 a a | D.a-2 |

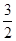 H2+
H2+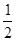 N2的平衡常数为:
N2的平衡常数为: ,因此,选A。
,因此,选A。