题目内容
19.下列说法不正确的是( )| A. | 等质量的N02与N204,所含质子数一定相等 | |
| B. | 等体积的N2O与NO2的原子总数一定相等 | |
| C. | 等物质的量的02与03的质量比为2:3 | |
| D. | 分子中含有相等原子数的NH3与H2的电子数之比为5:2 |
分析 根据n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$=$\frac{V}{{V}_{m}}$结合物质的构成计算.
解答 解:A.N02与N204的最简式都为N02,则等质量时质子数相等,故A正确;
B.如等体积的N2O与NO2的物质的量相等,则分子数相等,都为三原子分子,则原子数相等,但气体存在的条件不能确定,原子数不能确定,故B错误;
C.02与03的摩尔质量之比为2:3,则等物质的量的02与03的质量比为2:3,故C正确;
D.分子中含有相等原子数的NH3与H2的物质的量之比为1:2,则电子数之比为1×10:2×2=5:2,故D正确.
故选B.
点评 本题物质的量的相关计算,侧重于学生的分析、计算能力的考查,注意把握相关计算公式的运用,易错点为B,注意气体的存在条件,难度不大.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
9.某合作学习小组讨论辨析以下说法正确的是( )
①粗盐和酸雨都是混合物 ②沼气和水煤气都是可再生能源
③冰和干冰既是纯净物又是化合物 ④不锈钢和目前流通的硬币都是合金
⑤盐酸和食醋既是化合物又是酸 ⑥纯碱和熟石灰都是碱 ⑦利用丁达尔效应可以区分溶液和胶体.
①粗盐和酸雨都是混合物 ②沼气和水煤气都是可再生能源
③冰和干冰既是纯净物又是化合物 ④不锈钢和目前流通的硬币都是合金
⑤盐酸和食醋既是化合物又是酸 ⑥纯碱和熟石灰都是碱 ⑦利用丁达尔效应可以区分溶液和胶体.
| A. | ①②③④⑥ | B. | ①③④⑦ | C. | ③④⑤⑥⑦ | D. | ①②④⑤ |
10.下列有关金属腐蚀与防护的说法正确的是( )
| A. | 在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阴极的阳极保护法 | |
| B. | 当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用 | |
| C. | 纯银器表面在空气中因化学腐蚀渐渐变暗 | |
| D. | 可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀 |
14.12mol•L-1盐酸的密度为1.19g•cm-3,现取12mol•L-1盐酸100mL,加多少毫升水才能配成密度为1.1g•cm-3的6mol•L-1的盐酸( )
| A. | 100mL | B. | 99mL | C. | 101mL | D. | 98mL |
4.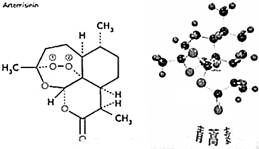 我国药学家屠呦呦于2015年获得诺贝尔奖,以表彰她发现并提纯青蒿素(Arteannuin),青蒿素对疟疾有良好的疗效,已知青蒿素的结构如图所示,下列说法正确的是( )
我国药学家屠呦呦于2015年获得诺贝尔奖,以表彰她发现并提纯青蒿素(Arteannuin),青蒿素对疟疾有良好的疗效,已知青蒿素的结构如图所示,下列说法正确的是( )
 我国药学家屠呦呦于2015年获得诺贝尔奖,以表彰她发现并提纯青蒿素(Arteannuin),青蒿素对疟疾有良好的疗效,已知青蒿素的结构如图所示,下列说法正确的是( )
我国药学家屠呦呦于2015年获得诺贝尔奖,以表彰她发现并提纯青蒿素(Arteannuin),青蒿素对疟疾有良好的疗效,已知青蒿素的结构如图所示,下列说法正确的是( )| A. | 青蒿素的分子式为C15H22O5 | B. | 青蒿素易溶于水 | ||
| C. | 1mol 青蒿素不能发生还原反应 | D. | 青蒿素中碳原子共有三种杂化方式 |
8.在101kPa和298K时,有关反应的热化学方程式有:
H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H1=-241.8kJ•mol-1
H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H2=-285.8kJ•mol-1
下列说法错误的是( )
H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H1=-241.8kJ•mol-1
H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H2=-285.8kJ•mol-1
下列说法错误的是( )
| A. | H2燃烧生成1 mol H2O(g)时,放出241.8 kJ的热量 | |
| B. | O2前面的$\frac{1}{2}$表示参加反应的O2的分子数目 | |
| C. | 燃烧热是以在101 kPa时,1 mol可燃物完全燃烧生成稳定的氧化物时所放出的热量定义的,则H2的燃烧热为285.8 kJ•mol-1 | |
| D. | 1 mol H2和$\frac{1}{2}$ mol O2所具有的总能量大于1mol H2O(g)所具有的总能量 |
