题目内容
【题目】向50mL18mol·L-1的硫酸中加入足量的铜片并加热,被还原的硫酸的物质的量是( )
A.等于0.9molB.大于0.45mol,小于0.9mol
C.等于0.45molD.小于0.45mol
【答案】D
【解析】
50mL18mol/L的硫酸中n(H2SO4)=18mol/L×0.05L=0.9mol,假设50mL18mol/L的硫酸中的硫酸分子全部与铜反应时,据Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O可知作氧化剂的硫酸为0.45mol,随着反应的进行,浓硫酸溶液的浓度逐渐减小,当成为稀硫酸时此反应停止,所以作氧化剂的硫酸的物质的量小于0.45mol,即被还原的硫酸的物质的量小于0.45mol。
CuSO4+SO2↑+2H2O可知作氧化剂的硫酸为0.45mol,随着反应的进行,浓硫酸溶液的浓度逐渐减小,当成为稀硫酸时此反应停止,所以作氧化剂的硫酸的物质的量小于0.45mol,即被还原的硫酸的物质的量小于0.45mol。
故选D。

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案
相关题目
【题目】1L某混合溶液,可能含有的离子如下表:
可能大量含有的阳离子 | H+、Mg2+、Al3+、NH4+ |
可能大量含有的阴离子 | Cl-、CO32- |
往该溶液中逐滴加入NaOH溶液,产生沉淀的物质的量(n)与加入NaOH溶液的体积(V)的关系如图所示。(NH4++OH- =NH3·H2O)
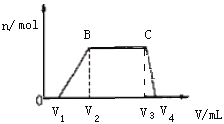
(1)该溶液中一定不含有的离子是___。
(2)V1、V2、V3、V4之间的关系___。
(3)V3V4段离子方程式为___。