题目内容
15. 常温下,向10mL 0.1mol•L-1的CH3COOH溶液中逐滴加入0.1mol•L-1 NaOH溶液,所得滴定曲线如图所示.下列说法一定正确的是( )
常温下,向10mL 0.1mol•L-1的CH3COOH溶液中逐滴加入0.1mol•L-1 NaOH溶液,所得滴定曲线如图所示.下列说法一定正确的是( )| A. | A点的pH为1 | |
| B. | B点时:2c(H+)+c(CH3COOH)═2c(OH-)+c(CH3COO-) | |
| C. | 在A→B之间:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| D. | C点时:c(H+)+c(Na+)═c(OH-)+c(CH3COO-) |
分析 A.醋酸是弱电解质,所以0.1mol/L的醋酸溶液中c(H+)<0.1mol/L;
B.任何电解质溶液中都存在电荷守恒和物料守恒,根据电荷守恒和物料守恒判断;
C.A-B之间,如果NaOH的量很少,可能存在c(Na+)<c(H+);
D.任何电解质溶液中都存在电荷守恒,根据电荷守恒判断.
解答 解:A.醋酸是弱电解质,所以0.1mol/L的醋酸溶液中c(H+)<0.1mol/L,所以未滴加NaOH的醋酸溶液pH>1,故A错误;
B.任何电解质溶液中都存在电荷守恒和物料守恒,醋酸和NaOH浓度相等,醋酸体积是NaOH的二倍,所以存在2c(Na+)═c(CH3COOH)+c(CH3COO-),根据电荷守恒得c(H+)+c(Na+)═c(OH-)+c(CH3COO-)、根据物料守恒得2c(Na+)═c(CH3COOH)+c(CH3COO-),所以得2c(H+)+c(CH3COOH)═2c(OH-)+c(CH3COO-),故B正确;
C.A-B之间,如果NaOH的量很少,可能存在c(Na+)<c(H+),故C错误;
D.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(H+)+c(Na+)═c(OH-)+c(CH3COO-),故D正确;
故选BD.
点评 本题考查酸碱混合溶液定性判断,为高频考点,明确溶液中的溶质及其性质是解本题关键,注意原子守恒、电荷守恒的应用,易错选项是C,采用极限法分析,题目难度不大.

练习册系列答案
相关题目
3.下列有机反应不属于取代反应的是 ( )
| A. | CH4+Cl2$\stackrel{光}{→}$CH3Cl+HCl | |
| B. | 2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O | |
| C. | 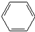 +HNO3$→_{△}^{浓硫酸}$ +HNO3$→_{△}^{浓硫酸}$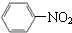 +H2O +H2O | |
| D. | CH3COOH+HOCH2CH3$→_{△}^{浓硫酸}$CH3COOCH2CH3+H2O |
7.下列除去杂质所选用的试剂或方法完全正确的是( )
| A. | 除去NaCl溶液中的少量I2:用无水乙醇,萃取分液 | |
| B. | 除 CO2中的少量HCl:通入饱和Na2CO3溶液,洗气 | |
| C. | 除乙烷中混有的少量乙烯:将气体通过酸性高锰酸钾溶液洗气 | |
| D. | 除去溴苯中混有的少量苯:蒸馏 |
4.下列物质名称书写正确的是( )
| A. | 石炭酸 | B. | 三溴笨酚 | C. | 乙酸乙脂 | D. | 硬酯酸钠 |
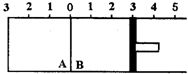 如图所示,温度不变时某容器分隔A、B两部分,A容积固定不变,B有可移动的活塞,现有A中充入2molSO2和1molO2,在B中充入2molSO3(g),在体积相同的条件下发生可逆反应:2SO2+O2?2SO3.根据下列要求填写空白:
如图所示,温度不变时某容器分隔A、B两部分,A容积固定不变,B有可移动的活塞,现有A中充入2molSO2和1molO2,在B中充入2molSO3(g),在体积相同的条件下发生可逆反应:2SO2+O2?2SO3.根据下列要求填写空白: .
.
 .
.
 ;
;