题目内容
在0℃和101kPa的条件下,将4.00g 氩气、1.40g 氮气和1.60g 氧气混合,该混合气体的密度是相同条件下氢气密度的( )A.35倍
B.14倍
C.7倍
D.17.5倍
【答案】分析:利用n= 计算各气体的物质的量,再利用
计算各气体的物质的量,再利用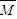 =
=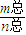 计算混合气体的平均摩尔质量,相同条件下,气体的摩尔质量之比等于密度之比,以此来解答.
计算混合气体的平均摩尔质量,相同条件下,气体的摩尔质量之比等于密度之比,以此来解答.
解答:解:n(Ar)=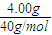 =0.1mol,n(N2)=
=0.1mol,n(N2)=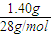 =0.05mol,n(O2)=
=0.05mol,n(O2)= =0.05mol,
=0.05mol,
则混合气体的平均摩尔质量为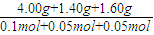 =35g/mol,
=35g/mol,
又相同条件下,气体的摩尔质量之比等于密度之比,
所以该混合气体的密度是相同条件下氢气密度的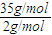 =17.5倍,
=17.5倍,
故选D.
点评:本题考查阿伏伽德罗定律及其推论,明确相同条件下气体的摩尔质量之比等于密度之比是解答本题的关键,注意平均摩尔质量的计算,题目难度不大.
 计算各气体的物质的量,再利用
计算各气体的物质的量,再利用 =
= 计算混合气体的平均摩尔质量,相同条件下,气体的摩尔质量之比等于密度之比,以此来解答.
计算混合气体的平均摩尔质量,相同条件下,气体的摩尔质量之比等于密度之比,以此来解答.解答:解:n(Ar)=
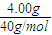 =0.1mol,n(N2)=
=0.1mol,n(N2)=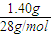 =0.05mol,n(O2)=
=0.05mol,n(O2)= =0.05mol,
=0.05mol,则混合气体的平均摩尔质量为
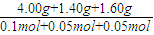 =35g/mol,
=35g/mol,又相同条件下,气体的摩尔质量之比等于密度之比,
所以该混合气体的密度是相同条件下氢气密度的
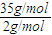 =17.5倍,
=17.5倍,故选D.
点评:本题考查阿伏伽德罗定律及其推论,明确相同条件下气体的摩尔质量之比等于密度之比是解答本题的关键,注意平均摩尔质量的计算,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
在0℃和101KPa下,2.00gHe、3.01×1022个N2、1.60gO2混合,该混合气体的体积是( )
| A、13.44 L | B、7.84 L | C、10.08 L | D、无法计算 |