题目内容
【题目】锌的化合物在工农业生产中有广泛的应用。请回答下列问题:
(1)基态锌原子中,核外电子占据的最高能级的符号是_________。锌的熔点比铝的熔点低,原因是______________。
(2)锌冶炼过程中会产生污染性气体二氧化硫,已知液态二氧化硫可以发生类似于水的自身电离2SO2(l)![]() SO2++
SO2++![]() ,S和O两种元素中电负性较强的是_______,与SO2+互为等电子体的单质分子为_______(填化学式),SO2+中的σ键和π键数目比为______________。
,S和O两种元素中电负性较强的是_______,与SO2+互为等电子体的单质分子为_______(填化学式),SO2+中的σ键和π键数目比为______________。
(3) [Zn(CN)4]2在水溶液中与HCHO发生如下反应:4HCHO+[Zn(CN)4]2+4H++4H2O![]() [Zn(H2O)4]2++4HOCH2CN,HOCH2CN分子中碳原子轨道的杂化类型是_________,HCHO的立体构型为_______________,[Zn(CN)4]2中Zn2+与CN中的C原子形成配位键,不考虑空间构型,[Zn(CN)4]2的结构可用示意图表示为__________________。
[Zn(H2O)4]2++4HOCH2CN,HOCH2CN分子中碳原子轨道的杂化类型是_________,HCHO的立体构型为_______________,[Zn(CN)4]2中Zn2+与CN中的C原子形成配位键,不考虑空间构型,[Zn(CN)4]2的结构可用示意图表示为__________________。
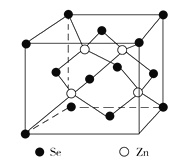
(4)硒化锌是一种重要的半导体材料,其晶胞结构如图所示,该晶胞中硒原子的配位数为_________。若该晶胞密度为ρ g·cm3,硒化锌的摩尔质量为M g/mol,NA代表阿伏加德罗常数,则晶胞参数a为__________cm。
【答案】4s 铝原子半径比锌原子半径小,价电子比锌原子多,金属键较强 O N2 1∶2 sp3、sp 平面三角形 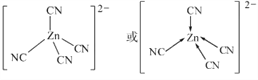 4
4 
【解析】
(1)基态锌原子中最高能级为4s,电子在吸收能量时会发生跃迁,变成激发态。锌的熔点比铝的熔点低,可从金属键的强弱判断。
(2)SO2+含有2个原子和10个价电子,因此与其互为等电子体的单质分子为氮气,因此SO2+的结构与氮气相似,σ键和π键数目比为1∶2。
(3)HOCH2CN的结构简式为 ,其中与羟基(—OH)相连的一个碳为饱和碳原子,价层电子对=4+0=4,杂化轨道类型为sp3,另外一碳原子与氮原子形成碳氮三键,三键含有1个σ键和2个π键,所以碳原子杂化轨道类型为sp;HCHO中碳原子杂化方式为sp2,立体构型是平面三角形。[Zn(CN)4]2中锌离子提供空轨道,C原子提供电子对形成配位键,结构示意图表示为:
,其中与羟基(—OH)相连的一个碳为饱和碳原子,价层电子对=4+0=4,杂化轨道类型为sp3,另外一碳原子与氮原子形成碳氮三键,三键含有1个σ键和2个π键,所以碳原子杂化轨道类型为sp;HCHO中碳原子杂化方式为sp2,立体构型是平面三角形。[Zn(CN)4]2中锌离子提供空轨道,C原子提供电子对形成配位键,结构示意图表示为: 。
。
(4)该晶胞中含有硒原子数为8×![]() +6×
+6×![]() =4,含有锌原子数为4,可得其化学式ZnSe。根据硒化锌晶胞结构图可知,每个锌原子周围有4个硒原子,而硒化锌的化学式为ZnSe,锌原子与硒原子个数相同,因此每个硒原子周围也有4个锌原子,所以硒原子的配位数为4。根据ρ=
=4,含有锌原子数为4,可得其化学式ZnSe。根据硒化锌晶胞结构图可知,每个锌原子周围有4个硒原子,而硒化锌的化学式为ZnSe,锌原子与硒原子个数相同,因此每个硒原子周围也有4个锌原子,所以硒原子的配位数为4。根据ρ=![]() =
=![]() ,所以V=
,所以V=![]() =a3,则a=
=a3,则a=  cm。
cm。

【题目】已知表中是某些有机物的模型图,根据要求回答下列问题:
有机物 | 甲 | 乙 | 丙 |
模型 |
|
|
|
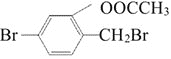
(1)甲的分子式是___________________,其一氯代物有___________________种。
(2)写出乙与![]() 的
的![]() 溶液发生反应的化学方程式:______________________________________,该反应的反应类型是___________________。
溶液发生反应的化学方程式:______________________________________,该反应的反应类型是___________________。
(3)丙的摩尔质量为![]() ,则用苯制备该物质时的催化剂是___________________。
,则用苯制备该物质时的催化剂是___________________。