题目内容
含硫化合物的种类很多,现有H2SO4、H2S、SO2、Na2SO3、BaSO4、FeS、CuSO4这7种常见的含硫化合物.某同学按以下思路开始探究:
(1)分类:若按酸碱盐氧化物进行分类,属于盐的共有
(2)完成下列含硫化合物间转变的化学反应方程式(试剂可任选):
FeS→H2S:
SO2→Na2SO3:
H2SO4→SO2:
(3)归纳总结:在水溶液中要完成化合价相同的含硫化合物之间相互转化一般所用的化学反应类型为
(4)十七大报告指出:节能减排成为国家发展战略目标.某火力发电厂所在地有较丰富的菱镁矿(主要成分为碳酸镁),请就地取材提出吸收二氧化硫的方法,写出有关化学方程式:
(1)分类:若按酸碱盐氧化物进行分类,属于盐的共有
4
4
种;若按硫元素化合价相同的分为一类,则这7种物质可分为3
3
类.(2)完成下列含硫化合物间转变的化学反应方程式(试剂可任选):
FeS→H2S:
FeS+H2SO4?H2S↑+FeSO4
FeS+H2SO4?H2S↑+FeSO4
.SO2→Na2SO3:
2NaOH+SO2?Na2SO3+H2O
2NaOH+SO2?Na2SO3+H2O
.H2SO4→SO2:
Na2SO3+H2SO4=Na2SO4+H2O+SO2↑
Na2SO3+H2SO4=Na2SO4+H2O+SO2↑
.(3)归纳总结:在水溶液中要完成化合价相同的含硫化合物之间相互转化一般所用的化学反应类型为
复分解反应
复分解反应
,要完成化合价不同的含硫化合物之间相互转化一般所用的化学反应类型为氧化还原反应
氧化还原反应
.(4)十七大报告指出:节能减排成为国家发展战略目标.某火力发电厂所在地有较丰富的菱镁矿(主要成分为碳酸镁),请就地取材提出吸收二氧化硫的方法,写出有关化学方程式:
MgCO3+SO2
MgSO3+CO22MgSO3+O2=2MgSO4
| ||
MgCO3+SO2
MgSO3+CO22MgSO3+O2=2MgSO4
.
| ||
分析:(1)若按酸碱盐氧化物进行分类,依据物质组成分析,溶液中电离出的阳离子全部是氢离子的化合物是酸,溶液中电离出的阴离子全部是氢氧根离子的化合物是碱,金属阳离子和酸根阴离子构成的化合物是盐;标注硫元素化合价,为+6价,+4价,-2价;
(2)硫化铁和稀硫酸反应生成硫化氢;
二氧化硫和氢氧化钠溶液 反应生成亚硫酸钠;
硫酸和亚硫酸盐反应生成二氧化硫气体;
(3)完成化合价相同的含硫化合物之间相互转化,反应前后硫元素化合价不变是复分解反应;化合价不同的含硫化合物之间相互转化是反应前后硫元素化合价变化是氧化还原反应;
(4)就地取材提出吸收二氧化硫的方法是利用二氧化硫和碳酸镁反应生成亚硫酸镁和二氧化碳,亚硫酸镁被氧气氧化为硫酸镁;
(2)硫化铁和稀硫酸反应生成硫化氢;
二氧化硫和氢氧化钠溶液 反应生成亚硫酸钠;
硫酸和亚硫酸盐反应生成二氧化硫气体;
(3)完成化合价相同的含硫化合物之间相互转化,反应前后硫元素化合价不变是复分解反应;化合价不同的含硫化合物之间相互转化是反应前后硫元素化合价变化是氧化还原反应;
(4)就地取材提出吸收二氧化硫的方法是利用二氧化硫和碳酸镁反应生成亚硫酸镁和二氧化碳,亚硫酸镁被氧气氧化为硫酸镁;
解答:解:(1)H2SO4、H2S、SO2、Na2SO3、BaSO4、FeS、CuSO4这7种常见的含硫化合物,若按酸碱盐氧化物进行分类,依据物质组成分析,溶液中电离出的阳离子全部是氢离子的化合物是酸,H2SO4、H2S;溶液中电离出的阴离子全部是氢氧根离子的化合物是碱,金属阳离子和酸根阴离子构成的化合物是盐,Na2SO3、BaSO4、FeS、CuSO4;两种元素组成,其中一种是氧元素的化合物,SO2;标注硫元素化合价,为+6价的是H2SO4、BaSO4、CuSO4,+4价为SO2、Na2SO3,-2价为H2S、FeS;
故答案为:4,3;
(2)硫化铁和稀硫酸反应生成硫化氢,反应的化学方程式为:FeS+H2SO4?H2S↑+FeSO4;
二氧化硫和氢氧化钠溶液 反应生成亚硫酸钠,反应的化学方程式为:2NaOH+SO2?Na2SO3+H2O;
硫酸和亚硫酸盐反应生成二氧化硫气体,反应的化学方程式为:Na2SO3+H2SO4=Na2SO4+H2O+SO2↑;
故答案为:FeS+H2SO4?H2S↑+FeSO4;2NaOH+SO2?Na2SO3+H2O;Na2SO3+H2SO4=Na2SO4+H2O+SO2↑;
(3)完成化合价相同的含硫化合物之间相互转化,反应前后硫元素化合价不变是复分解反应;化合价不同的含硫化合物之间相互转化是反应前后硫元素化合价变化是氧化还原反应;
故答案为:复分解反应,氧化还原反应;
(4)就地取材提出吸收二氧化硫的方法是利用二氧化硫和碳酸镁反应生成亚硫酸镁和二氧化碳,亚硫酸镁被氧气氧化为硫酸镁,反应的化学方程式为:MgCO3+SO2
MgSO3+CO2 2MgSO3+O2=2MgSO4;
故答案为:MgCO3+SO2
MgSO3+CO2 2MgSO3+O2=2MgSO4;
故答案为:4,3;
(2)硫化铁和稀硫酸反应生成硫化氢,反应的化学方程式为:FeS+H2SO4?H2S↑+FeSO4;
二氧化硫和氢氧化钠溶液 反应生成亚硫酸钠,反应的化学方程式为:2NaOH+SO2?Na2SO3+H2O;
硫酸和亚硫酸盐反应生成二氧化硫气体,反应的化学方程式为:Na2SO3+H2SO4=Na2SO4+H2O+SO2↑;
故答案为:FeS+H2SO4?H2S↑+FeSO4;2NaOH+SO2?Na2SO3+H2O;Na2SO3+H2SO4=Na2SO4+H2O+SO2↑;
(3)完成化合价相同的含硫化合物之间相互转化,反应前后硫元素化合价不变是复分解反应;化合价不同的含硫化合物之间相互转化是反应前后硫元素化合价变化是氧化还原反应;
故答案为:复分解反应,氧化还原反应;
(4)就地取材提出吸收二氧化硫的方法是利用二氧化硫和碳酸镁反应生成亚硫酸镁和二氧化碳,亚硫酸镁被氧气氧化为硫酸镁,反应的化学方程式为:MgCO3+SO2
| ||
故答案为:MgCO3+SO2
| ||
点评:本题考查了硫及其化合物性质的应用,主要是化学方程式书写,物质分类方法的应用,吸收二氧化硫气体的原料利用原理,题目难度中等.

练习册系列答案
 全优点练单元计划系列答案
全优点练单元计划系列答案
相关题目
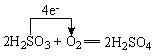
 上解释为发生了钝化,但有人认为未发生反应。为验证此过程,某同学经过思考,设计了如下实
上解释为发生了钝化,但有人认为未发生反应。为验证此过程,某同学经过思考,设计了如下实 验:将经浓硫酸处理过的铁棒洗净后置于CuSO4溶液中,若铁棒表面 ,则发生了钝化;若铁棒表面 ,则未发生反应。
验:将经浓硫酸处理过的铁棒洗净后置于CuSO4溶液中,若铁棒表面 ,则发生了钝化;若铁棒表面 ,则未发生反应。 2CuO,CuO+ H2SO4= CuSO4+H2O,
2CuO,CuO+ H2SO4= CuSO4+H2O,