题目内容
下列物质性质变化规律正确的是( )
| A、金属Na、Mg、Al的硬度依次降低 |
| B、O、F、H的原子半径依次减小 |
| C、干冰、钠、冰的熔点依次降低 |
| D、HI、HBr、HCl的熔点依次升高 |
考点:微粒半径大小的比较,分子间作用力对物质的状态等方面的影响
专题:元素周期律与元素周期表专题,化学键与晶体结构
分析:A.金属键键能越大,金属硬度越大,从影响金属键强弱的角度比较;
B.H原子半径最小,结合同周期原子半径的递变规律比较;
C.Na的熔点最高;
D.分子的相对分子质量越大,熔沸点越高.
B.H原子半径最小,结合同周期原子半径的递变规律比较;
C.Na的熔点最高;
D.分子的相对分子质量越大,熔沸点越高.
解答:
解:A.Na、Mg、Al原子半径逐渐减小,离子带电荷数目逐渐增大,金属键键能逐渐增强,则金属硬度逐渐增大,故A错误;
B.H原子半径最小,O、F位于相同周期,原子半径O大于F,故B正确;
C.Na为金属,常温下为固体,熔点最高,故C错误;
D.HI、HBr、HCl都为分子晶体,且不含氢键,分子的相对分子质量越大,熔沸点越高,故D错误.
故选B.
B.H原子半径最小,O、F位于相同周期,原子半径O大于F,故B正确;
C.Na为金属,常温下为固体,熔点最高,故C错误;
D.HI、HBr、HCl都为分子晶体,且不含氢键,分子的相对分子质量越大,熔沸点越高,故D错误.
故选B.
点评:本题考查晶体类型以及晶体性质的比较,为高频考点,侧重于学生的分析能力和基本概念、基本理论的综合理解和运用的考查,注意相关基础知识的积累,难度不大.

练习册系列答案
相关题目
下列表示物质结构的化学用语或说法中,正确的是( )
A、8个中子的碳原子的核素符号:
| ||
B、HF的电子式: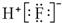 | ||
C、次氯酸的电子式: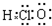 | ||
| D、CCl4分子的每个原子都满足8电子稳定结构 |
下列反应中HNO3既表现出酸性又表现出强氧化性的是( )
| A、稀硝酸与Fe2O3反应 |
| B、稀硝酸与NaOH溶液反应 |
| C、浓硝酸与灼热的碳反应 |
| D、浓硝酸与铜反应 |
可以验证硫元素的非金属性比氯元素弱的事实是( )
①硫和氢气在加热条件下能形成H2S、H2S受热300℃左右分解.氯气和氢气在点燃或光照下生成 氯化氢,氯化氢很难分解
②向氢硫酸溶液中滴入氯水有单质硫生成
③硫、氯气分别与铜和铁反应产物是FeS、Cu2S、FeCl3、CuCl2
④高氯酸(HClO4)的酸性强于硫酸.
①硫和氢气在加热条件下能形成H2S、H2S受热300℃左右分解.氯气和氢气在点燃或光照下生成 氯化氢,氯化氢很难分解
②向氢硫酸溶液中滴入氯水有单质硫生成
③硫、氯气分别与铜和铁反应产物是FeS、Cu2S、FeCl3、CuCl2
④高氯酸(HClO4)的酸性强于硫酸.
| A、①②③④ | B、只有①② |
| C、只有②③④ | D、只有③④ |
某芳香有机化合物,只含碳、氢、氧三种元素,且只含有一个氧原子,蒸汽的相对密度是氢气的54倍,它可能的结构共有(不考虑立体异构)( )
| A、3种 | B、4种 | C、5种 | D、6种 |
下列说法正确的是( )
| A、非金属元素都是主族元素 |
| B、主族元素的次外层电子数都是8 |
| C、稀有气体元素都是非金属元素 |
| D、主族元素都是短周期元素 |
NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A、78g Na2O2固体中含有的阴阳离子总数为3NA |
| B、1mol?L-1 NaOH溶液中含有NA个Na+ |
| C、标准状况下,2.24L CCl4中含有的C-Cl键的数目为0.4NA |
| D、常温常压下,4.4g CO2和N2O混合物中所含有的原子数为0.3NA |
某温度下在一容积可变的容器中,反应3A(g)+B(g)?C(g),达到平衡后A、B、C的物质的量分别为6mol、2mol和6mol,保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是( )
| A、均加倍 |
| B、均减半 |
| C、均增加1mol |
| D、均减少1mol |