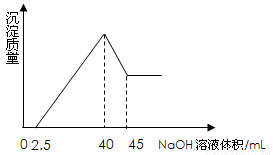
题目内容
取一定量的铝土矿(含Al2O3、Fe2O3、SiO2)样品,放入盛有100 mL H2SO4溶液的烧杯中,充分反应后过滤,向滤液中加入10 mol/L的NaOH溶液,产生沉淀的量与所加NaOH溶液的体积的关系如图所示。则原H2SO4物质的量浓度是

A.1mol/L B.2mol/L C.3mol/L D.4mol/L
【答案】
B
【解析】根据图像可知,当沉淀不再变化时,溶液中的溶质是硫酸钠。所以根据原子守恒可知,硫酸钠的物质的量是10mol/L×0.04L÷2=0.2mol,因此硫酸的浓度是0.2mol÷0.1l=2mol/L,答案选B。

练习册系列答案
相关题目
取一定量的铝土矿(含Al2O3、Fe2O3、SiO2)样品,放入盛有100 mL H2SO4溶液的烧杯中,充分反应后过滤,向滤液中加入10 mol/L的NaOH溶液,产生沉淀的量与所加
NaOH溶液的体积的关系如图所示。则原H2SO4物质的量浓度是: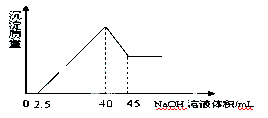
| A.1mol/L | B.2mol/L | C.3mol/L | D.4mol/L |
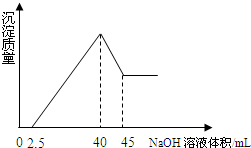 取一定量的铝土矿(含Al2O3、Fe2O3、SiO2)样品,放入盛有100mL H2SO4溶液的烧杯中,充分反应后过滤,向滤液中加入10mol/L的NaOH溶液,产生沉淀的量与所加NaOH溶液的体积的关系如图所示.则原H2SO4物质的量浓度是( )
取一定量的铝土矿(含Al2O3、Fe2O3、SiO2)样品,放入盛有100mL H2SO4溶液的烧杯中,充分反应后过滤,向滤液中加入10mol/L的NaOH溶液,产生沉淀的量与所加NaOH溶液的体积的关系如图所示.则原H2SO4物质的量浓度是( )