题目内容
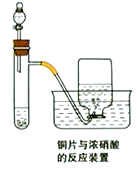
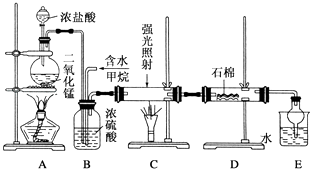
【题目】如图是实验室制备氯气并进行一系列相关实验的装置(夹持及加热仪器已略)。
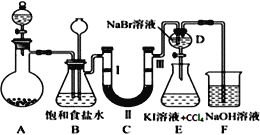
(1)装置 A 中反应的化学反应方程式为:________________________________。装置 B 中饱和食盐水的作用是___________________;同时装置 B 亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时 B 中的现象________________________________。
(2)装置 C 的实验目的是验证氯气是否具有漂白性,为此 C 中Ⅰ、Ⅱ、Ⅲ依次放入_____________。(填序号)
a | b | c | d | |
Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(3)设计装置 D、 E 的目的是验证氯、溴、碘单质的氧化性强弱(Cl2> Br2>I2),当向D中缓缓通入少量氯气时,可以看到无色溶液逐渐变为橙黄色,说明Cl2氧化性>Br2,打开活塞,将装置D中少量溶液加入装置 E中,振荡,观察到的现象是________________________________。
(4)工业上将氯气通入石灰乳制取漂白粉, 化学反应方程式为_____________________________,漂白粉敞放于空气中会失效,请写出失效所发生反应的化学方程式_____________________________。
【答案】 MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O 除去Cl2中的 HCl B中锥形瓶水位下降,长颈漏斗中液面上升,形成水柱 d 下层溶液呈紫色 2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O Ca(ClO)2+CO2+H2O = 2HClO+CaCO3 2HClO
MnCl2+Cl2↑+2H2O 除去Cl2中的 HCl B中锥形瓶水位下降,长颈漏斗中液面上升,形成水柱 d 下层溶液呈紫色 2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O Ca(ClO)2+CO2+H2O = 2HClO+CaCO3 2HClO![]() 2HCl + O2↑
2HCl + O2↑
【解析】(1)装置A制备氯气,则其中反应的化学反应方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O。浓盐酸易挥发,生成的氯气中含有氯化氢,则装置B中饱和食盐水的作用是除去Cl2中的HCl;发生堵塞时B中压强增大,会形成一段水柱,则实验现象B中锥形瓶水位下降,长颈漏斗中液面上升,形成水柱。(2)装置C的实验目的是验证氯气是否具有漂白性,验证氯气是否具有漂白性,要验证干燥氯气无漂白性,湿润的有色布条中,氯气和水反应生成次氯酸具有漂白性,选项中abc的Ⅱ中都是干燥剂,再通入湿润的有色布条不能验证氯气的漂白性,所以C中I、II、III依次放入湿润的有色布条、无水氯化钙、干燥的有色布条,所以选d;(3)D中是溴化钠,当向D中缓缓通入少量氯气时,可以看到无色溶液逐渐变为橙黄色,氧化还原反应中氧化剂的氧化性大于氧化产物,说明氯气的氧化性强于溴;打开活塞,将装置D中含溴单质的少量溶液加入含碘化钾和四氯化碳的装置E中,溴单质和碘化钾反应生成碘单质,碘单质溶于四氯化碳呈紫红色,振荡.观察到的现是:E中溶液分为两层,下层为紫红色;(4)工业上将氯气通入石灰乳制取漂白粉,反应的化学反应方程式为2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O,漂白粉敞放于空气中会失效,是由于次氯酸钙吸收水蒸气和二氧化碳生成次氯酸,次氯酸分解生成氯化氢和氧气,则失效所发生反应的化学方程式为Ca(ClO)2+CO2+H2O=2HClO+CaCO3、2HClO
MnCl2+Cl2↑+2H2O。浓盐酸易挥发,生成的氯气中含有氯化氢,则装置B中饱和食盐水的作用是除去Cl2中的HCl;发生堵塞时B中压强增大,会形成一段水柱,则实验现象B中锥形瓶水位下降,长颈漏斗中液面上升,形成水柱。(2)装置C的实验目的是验证氯气是否具有漂白性,验证氯气是否具有漂白性,要验证干燥氯气无漂白性,湿润的有色布条中,氯气和水反应生成次氯酸具有漂白性,选项中abc的Ⅱ中都是干燥剂,再通入湿润的有色布条不能验证氯气的漂白性,所以C中I、II、III依次放入湿润的有色布条、无水氯化钙、干燥的有色布条,所以选d;(3)D中是溴化钠,当向D中缓缓通入少量氯气时,可以看到无色溶液逐渐变为橙黄色,氧化还原反应中氧化剂的氧化性大于氧化产物,说明氯气的氧化性强于溴;打开活塞,将装置D中含溴单质的少量溶液加入含碘化钾和四氯化碳的装置E中,溴单质和碘化钾反应生成碘单质,碘单质溶于四氯化碳呈紫红色,振荡.观察到的现是:E中溶液分为两层,下层为紫红色;(4)工业上将氯气通入石灰乳制取漂白粉,反应的化学反应方程式为2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O,漂白粉敞放于空气中会失效,是由于次氯酸钙吸收水蒸气和二氧化碳生成次氯酸,次氯酸分解生成氯化氢和氧气,则失效所发生反应的化学方程式为Ca(ClO)2+CO2+H2O=2HClO+CaCO3、2HClO![]() 2HCl+O2↑。
2HCl+O2↑。

【题目】在一定体积的密闭容器中,进行如下化学反应:CO(g)+H2O (g)CO2(g)+H2(g),其化学平衡常数K和温度t的关系如表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K= , 该反应为反应(填吸热或放热).若改变条件使平衡向正反应方向移动,则平衡常数(填序号)
①一定不变 ②一定减小 ③可能增大 ④增大、减小、不变皆有可能
(2)能判断该反应是否达到化学平衡状态的依据是 .
(a)容器中压强不变 (b)混合气体中c(CO)不变
(c)v逆(H2)=v正(H2O) (d)c(CO)=c(CO2)
(3)将不同量的CO (g) 和H2O (g) 分别通入到体积为2L的恒容密闭容器中,进行反应CO (g)+H2O (g)CO2(g)+H2(g),得到如表三组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
H2O | CO | CO2 | CO | |||
A | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
B | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
C | 1000 | 1 | 2 | c | d | t |
①实验B中平衡时H2O (g)的物质的量是 .
②通过计算可知,CO的转化率实验A实验B(填“大于”、“等于”或“小于”).
③若实验C中达到平衡所需时间 t3(填“大于”、“等于”或“小于”)
【题目】表为元素周期表的一部分:
IA | IIA | IIIA | IVA | VA | VIA | VIIA | ||
二 | C | N | ① | |||||
三 | ② | ③ | ④ | P | ⑤ | ⑥ |
请填写下列空白:
(1)表中元素,原子半径最大的是(填写元素符号);①的核外电子排布式;③和⑥两元素形成化合物的电子式为 .
(2)②③④三种元素最高价氧化物对应的水化物中,碱性最强的是(填化学式).
(3)比较④、⑤两种元素的简单离子半径:>(填离子符号);元素④最高价氧化物对应的水化物与硝酸反应的离子方程式为 .
(4)列举一个事实来证明元素①比元素⑤的非金属性强 .
(5)若8g甲烷气体完全燃烧生成液态水时放出445.15kJ的热量,请写出其热化学方程式 .