题目内容
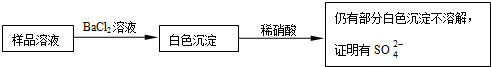
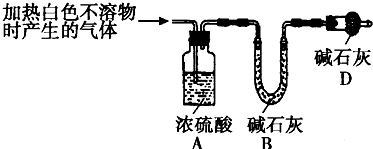
某同学设计了如下实验,以测定CaCO3、(NH4)2CO3和NH4Cl固体混合物中氮元素的质量分数.实验过程如图所示:

请回答:
(1)操作①和②的名称分别是______.
(2)原样品中氮元素的质量分数为______(用含W、m的代数式表示).
(3)若该同学由于操作不当而使测定结果偏低,其原因可能是______(填字母).
a.试剂①用量不足
b.固体未经洗涤
c.试剂②用量不足
d.气体C未经干燥.
解:(1)样品经操作①和②可得沉淀和溶液,则应为首先加水溶解,过滤后得到沉淀,故答案为:溶解、过滤;
(2)溶液A为(NH4)2CO3和NH4Cl的混合物,加入足量NaOH浓溶液加热可得氨气,m(NH3)=mg,则m(N)=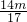 g,
g,
则原样品中氮元素的质量分数为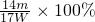 ,故答案为:
,故答案为: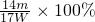 ;
;
(3)a.试剂①用量不足,会导致铵盐不能完全溶解,则测定的含氮量偏低,故a正确;
b.固体未经洗涤,固体表面会吸附铵根离子,测定的含氮量偏低,故b正确;
c.试剂②用量不足,不能是铵根离子全部转化为氨气而被吸收,则 测定的含氮量偏低,故c正确;
d.气体C未经干燥,会使测定结果偏低,故d错误.
故答案为:abc.
分析:样品首先加水溶解,过滤后得到的沉淀为CaCO3,溶液A为(NH4)2CO3和NH4Cl的混合物,加入足量NaOH浓溶液加热可得氨气,用浓硫酸吸收氨气可得样品中氮元素的质量分数,以此解答该题.
点评:本题考查物质的含量测定的实验设计,侧重于学生的实验探究和分析能力的考查,题目难度中等,注意把握实验原理和操作注意事项.
(2)溶液A为(NH4)2CO3和NH4Cl的混合物,加入足量NaOH浓溶液加热可得氨气,m(NH3)=mg,则m(N)=
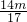 g,
g,则原样品中氮元素的质量分数为
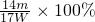 ,故答案为:
,故答案为: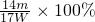 ;
;(3)a.试剂①用量不足,会导致铵盐不能完全溶解,则测定的含氮量偏低,故a正确;
b.固体未经洗涤,固体表面会吸附铵根离子,测定的含氮量偏低,故b正确;
c.试剂②用量不足,不能是铵根离子全部转化为氨气而被吸收,则 测定的含氮量偏低,故c正确;
d.气体C未经干燥,会使测定结果偏低,故d错误.
故答案为:abc.
分析:样品首先加水溶解,过滤后得到的沉淀为CaCO3,溶液A为(NH4)2CO3和NH4Cl的混合物,加入足量NaOH浓溶液加热可得氨气,用浓硫酸吸收氨气可得样品中氮元素的质量分数,以此解答该题.
点评:本题考查物质的含量测定的实验设计,侧重于学生的实验探究和分析能力的考查,题目难度中等,注意把握实验原理和操作注意事项.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 (2013?闸北区二模)含有硫的化合物在工业生产中应用广泛,回答下列问题:
(2013?闸北区二模)含有硫的化合物在工业生产中应用广泛,回答下列问题: