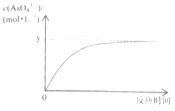
题目内容
【题目】下图中A~H均为中学化学中常见的物质,A、B、H是气体,它们之间有如下转化关系。(反应中生成的水已略去)
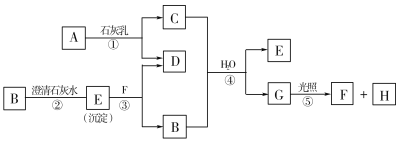
请回答以下问题:
(1)E是_____________,F是______________,H是_____________。(填化学式)
(2)C物质在日常生活中可作______________剂。
(3)写出反应①的化学方程式:_________________________。
【答案】CaCO3 HCl O2 消毒(或漂白) 2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O
【解析】
B可与澄清石灰水反应生成沉淀,应为CO2,则E为CaCO3,常见能与石灰水反应的气体还有氯气,则A应为Cl2,由此可以知道C为Ca(ClO)2,F为HCl,D为CaCl2,G为HClO,H为O2,结合对应物质的性质以及题目要求可解答该题。
B可与澄清石灰水反应生成沉淀,应为CO2,则E为CaCO3,常见能与石灰水反应的气体还有氯气,则A应为Cl2,由此可以知道C为Ca(ClO)2,F为HCl,D为CaCl2,G为HClO,H为O2;
(1) 由以上分析可以知道E为CaCO3,H为O2,F是HCl;
答案是:CaCO3 ;HCl;O2;
(2)C为Ca(ClO)2,可生成HClO,具有强氧化性和漂白性,可用于消毒或漂白;
答案是:消毒(或漂白);
(3)反应①的化学方程式为:2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O;
故答案是:2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】[化学一选修3:物质结构与性质
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得。
①基态Ti3+的未成对电子数有__________个。
②LiBH4由Li+和BH4-构成,BH4-的空间构型是__________,B原子的杂化轨道类型是_____。
③某储氢材料是第三周期金属元素M的氢化物,M的部分电离能如下表所示:
I1/kJ·mol-1 | I2/kJ·mol-1 | I3/kJ·mol-1 | I4/kJ·mol-1 | I5/kJ·mol-1 |
738 | 1451 | 7733 | 10540 | 13630 |
M是_______(填元素符号),判断理由为_______________。
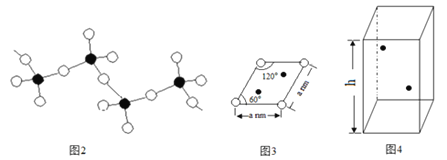
(2)铜晶体中铜原子的堆积方式如图所示,铜晶体中原子的堆积模型属于____________。

(3)A原子的价电子排布式为3s23p5,铜与A 形成化合物的晶胞如图所示(黑点代表铜原子)。
①该晶体的化学式为______________。
②该化合物难溶于水但易溶于氨水,其原因是_____________ ,此化合物的氨水溶液遇到空气则被氧化为深蓝色,深蓝色溶液中阳离子的化学式为____________。
③己知该晶体的密度为ρg·cm-3,阿伏伽德罗常数为NA,己知该晶体中Cu原子和A原子之间的最短距离为体对角线的1/4,则该晶体中Cu原子和A原子之间的最短距离为________pm。
【题目】某温度下,SO2和O2发生反应:2SO2(g)+O2(g)=== 2SO3(g),SO2的浓度随反应时间(t)的变化如下表。在0~10 s内,平均反应速率为( )
t/s | 0 | 5 | 10 | 15 |
SO2/(mol·L-1) | 0.82 | 0.40 | 0.32 | 0.28 |
A.v(SO2)=0.032 mol·L-1B.v(SO2)=0.050 mol·L-1
C.v(SO2)=0.050 mol·L-1·s-1D.v(SO2)=0.032 mol·L-1·s-1
【题目】下列根据实验操作、现象得出相应结论一定正确的是
选项 | 实验操作、现象 | 实验结论 |
A | 用pH计测定同浓度NaF溶液和CH3COONa溶液: pH(NaF)<pH(CH3COONa) | 酸性:HF>CH3COOH |
B | 向2mL 0.5mol/L FeCl3溶液中滴加2mL 1mol/L KSCN溶液,振荡后静置,观察到溶液变成红色,加入1mL 2mol/L KCl溶液后溶液红色变浅 | c(KCl)增大使该反应 FeCl3+3KSCN 的化学平衡逆向移动 |
C | 向盛有2ml0.1mol·L-1AgNO3的试管中滴加5滴0.1mol·L-1NaCl溶液,出现白色沉淀;再往试管中滴加5滴0.1mol·L-1KI溶液,出现黄色沉淀 | KSP(AgCl)>KSP(AgI) |
D | 将10mL2mol/L FeCl3的溶液与1mL1mol/LKI溶液混合充分反应后滴加KSCN,溶液颜色变红 | KI与FeCl3反应有可逆性 |
A.AB.BC.CD.D
【题目】下表是元素周期表的一部分,针对表中的①~⑩种元素,请用化学用语回答下列问题:
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | ⑥ | ⑦ | ⑧ | |||||
3 | ① | ③ | ⑤ | ⑨ | ⑩ | |||
4 | ② | ④ |
(1)在③~⑦元素中,原子半径最大的是__________(填元素符号);
(2)⑦元素的最高价氧化物对应的水化物与其氢化物能生成盐M,M中含有的化学键类型有__________________;
(3)写出元素①和⑧的单质在加热条件下反应生成的化合物的电子式:_________。
(4
(5)①~⑨中元素最高价氧化物对应的水化物中酸性最强的是_____________(填物质化学式);呈两性的氢氧化物是_________(填物质化学式),该化合物与NaOH溶液反应的离子方程式为___________。
(6)用电子式表示元素③与⑨形成化合物的过程_____________________________。