题目内容
将11.9 g由Mg、Al、Fe组成的合金溶于足量的NaOH溶液中,合金质量减少了2.7 g。另取等质量的合金溶于过量稀硝酸中,生成了6.72 L NO(标准状况下),向反应后的溶液中加入适量NaOH溶液恰好使Mg2+、Al3+、Fe3+完全转化为沉淀,则沉淀的质量为( )
A.22.1 g B.27.2 g C.30 g D.无法计算
B
【解析】由质量守恒知,m(沉淀)=m(合金)+m(OH-),由电荷守恒和得失电子守恒知,n(OH-)=3n(NO),则m(沉淀)=11.9 g+3×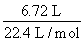 ×17 g/mol =27.2 g,故选B项。
×17 g/mol =27.2 g,故选B项。
守恒法在金属的有关计算中的应用
(1)金属失电子的物质的量等于酸得电子的物质的量;
(2)金属失电子的物质的量等于生成金属阳离子所带正电荷的物质的量;
(3)生成金属阳离子所带正电荷的物质的量等于金属阳离子所结合OH-的物质的量。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目



