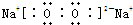题目内容
有原子序数依次增大的A、B、C、D、E五种短周期元素,它们可以组成甲、乙、丙、丁四种化合物,各化合物中原子个数比如下表。
| 甲 | 乙 | 丙 | 丁 |
化合物中各元素原子个数比 | A∶C=1∶1 | B∶A=1∶2 | D∶E=1∶3 | B∶E=1∶4 |
其中A、B两种原子的核电荷数之差等于它们的原子最外层电子数之和;B原子最外层电子数比其次外层电子数多2个;在周期表中,C是E的邻族元素,化学性质活泼;D和E则位于同周期,且D和E的原子序数之和为30。
(1)D和E同属于哪一周期元素?推断依据是什么?
(2)根据题目提供的条件,推断E在周期表中的族序数所必要的条件是什么?
(3)向甲的水溶液中加入MnO2,反应的化学方程式是____________________________。
(4)已知乙的相对分子质量小于甲。写出实验室制取乙的化学方程式:__________________。
(5)丙的水溶液呈酸性,与饱和NaHCO3溶液反应,会迅速产生大量气体和难溶物,有关离子方程式是_______________________________________。
(6)向 3 mL 1 mol·L-1 KI溶液中依次注入下列试剂:①1 mL 5 mol·L-1盐酸;②0.5 mL 30%甲溶液;③1 mL 丁,经充分振荡后,静止,可得一紫色溶液。这种紫色溶液是_________。
据题意推断出A、B、C、D、E五元素分别为H、C、O、Al、Cl。
(1)D、E同属于第3周期元素,因为它们的原子序数平均值为15,正好在第3周期元素的原子序数(11~18)范围内。
(2)要推断E的族序数,需要知道丙中各原子的个数比:D∶E=1∶3。
(5)Al3++3![]() ==Al(OH)3↓+3CO2↑
==Al(OH)3↓+3CO2↑
(6)I2的CCl4溶液

练习册系列答案
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案
相关题目


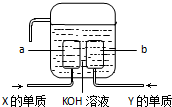 有原子序数依次增大的4种短周期元素X、Y、Z、W,已知:
有原子序数依次增大的4种短周期元素X、Y、Z、W,已知: