题目内容
有原子序数依次增大的4种短周期元素X、Y、Z、W,已知:
①X与Z、Y与W分别同主族;
②X与Y能形成X2Y、X2Y2两种共价化合物;
③Y的阴离子(单核)与Z的阳离子的核外电子数都为10;
④W原子的最外层电子数为K层电子数的3倍.
试根据以上叙述填空.
(1)W的原子结构示意图为 ; X、Y与Z形成的化合物的电子式为 .
(2)Z与W的离子半径大小为Z W (填“>”、“<”或“=”).
(3)Z与W形成的化合物溶于水显 性(填“酸”或“碱”),原因是(用离子方程式表示) .
①X与Z、Y与W分别同主族;
②X与Y能形成X2Y、X2Y2两种共价化合物;
③Y的阴离子(单核)与Z的阳离子的核外电子数都为10;
④W原子的最外层电子数为K层电子数的3倍.
试根据以上叙述填空.
(1)W的原子结构示意图为
(2)Z与W的离子半径大小为Z
(3)Z与W形成的化合物溶于水显
分析:有原子序数依次增大的4种短周期元素X、Y、Z、W.W原子的最外层电子数为K层电子数的3倍,最外层电子数为6,处于ⅥA族,Y与W分别同主族,Y的阴离子(单核)的核外电子数为10,则Y为氧元素、W为硫元素;X与Y能形成X2Y、X2Y2两种共价化合物,则X为氢元素;X与Z同主族,Z的阳离子的核外电子数为10,则Z为Na元素,据此解答.
解答:解:有原子序数依次增大的4种短周期元素X、Y、Z、W.W原子的最外层电子数为K层电子数的3倍,最外层电子数为6,处于ⅥA族,Y与W分别同主族,Y的阴离子(单核)的核外电子数为10,则Y为氧元素、W为硫元素;X与Y能形成X2Y、X2Y2两种共价化合物,则X为氢元素;X与Z同主族,Z的阳离子的核外电子数为10,则Z为Na元素,
(1)W为硫元素,原子核外有3个电子层,最外层电子数为6,原子结构示意图为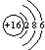 ;
;
H、O与Na形成的化合物为NaOH,其电子式为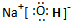 ,
,
故答案为: ;
;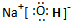 ;
;
(2)电子层越多离子半径越大,故离子半径Na+<S2-,
故答案为:<;
(3)Z与W形成的化合物为Na2S,溶液中水S2-水解S2-+H2O?HS-+OH-,破坏水的电离平衡,溶液呈碱性,
故答案为:碱;S2-+H2O?HS-+OH-.
(1)W为硫元素,原子核外有3个电子层,最外层电子数为6,原子结构示意图为
 ;
;H、O与Na形成的化合物为NaOH,其电子式为
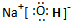 ,
,故答案为:
 ;
;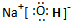 ;
;(2)电子层越多离子半径越大,故离子半径Na+<S2-,
故答案为:<;
(3)Z与W形成的化合物为Na2S,溶液中水S2-水解S2-+H2O?HS-+OH-,破坏水的电离平衡,溶液呈碱性,
故答案为:碱;S2-+H2O?HS-+OH-.
点评:本题考查结构性质位置关系、常用化学用语、盐类水解等,难度不大,推断元素是解题的根据,W的最外层电子数的确定是推断的突破口.

练习册系列答案
相关题目


 有原子序数依次增大的4种短周期元素X、Y、Z、W,已知:
有原子序数依次增大的4种短周期元素X、Y、Z、W,已知:
