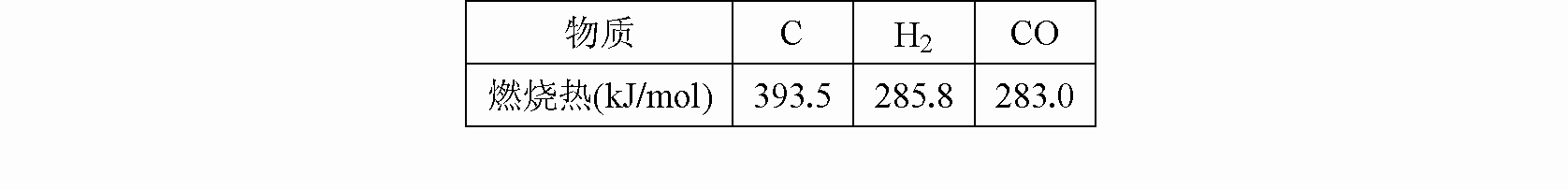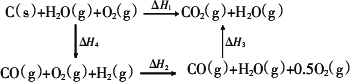题目内容
已知:①将煤转化为水煤气的主要化学反应为C(s)+H2O(g)
CO(g)+H2(g);
②C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:
C(s)+O2(g)═CO2(g);△H=-393.5kJ?mol-1
H2(g)+
O2(g)═H2O(g);△H=-242.0kJ?mol-1
CO(g)+
O2═CO2(g);△H=-283.0kJ?mol-1
请回答:
(1)根据以上数据,写出C(s)与水蒸气反应的热化学反应方程式:
(2)比较反应热数据可知,1mol CO(g)和1mol H2(g)完全燃烧放出的热量之和比1mol C(s)完全燃烧放出的热量多.甲同学据此认为“煤转化为水煤气可以使煤燃烧放出更多的热量”;乙同学根据盖斯定律做出下列循环图:
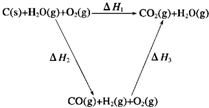
并据此认为“煤转化为水煤气再燃烧放出的热量与煤直接燃烧放出的热量相等”.
请分析:甲、乙两同学观点正确的是
(3)将煤转化为水煤气作为燃料和煤直接燃烧相比有很多优点,请列举其中的两个优点
(4)已知热化学方程式:
Mg(OH)2(s)=MgO(s)+H2O(g)△H1=+81.5kJ?mol-1
Al(OH)3(s)=
Al2O3(s)+
H2O(g)△H2=+87.7kJ?mol-1
①Mg(OH)2和Al(OH)3起阻燃作用的主要原因是
②等质量Mg(OH)2和Al(OH)3相比,阻燃效果较好的是
| ||
②C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:
C(s)+O2(g)═CO2(g);△H=-393.5kJ?mol-1
H2(g)+
| 1 |
| 2 |
CO(g)+
| 1 |
| 2 |
请回答:
(1)根据以上数据,写出C(s)与水蒸气反应的热化学反应方程式:
C(s)+H2O(g)=CO(g)+H2(g)△H=+131.5 kJ?mol-1
C(s)+H2O(g)=CO(g)+H2(g)△H=+131.5 kJ?mol-1
.(2)比较反应热数据可知,1mol CO(g)和1mol H2(g)完全燃烧放出的热量之和比1mol C(s)完全燃烧放出的热量多.甲同学据此认为“煤转化为水煤气可以使煤燃烧放出更多的热量”;乙同学根据盖斯定律做出下列循环图:

并据此认为“煤转化为水煤气再燃烧放出的热量与煤直接燃烧放出的热量相等”.
请分析:甲、乙两同学观点正确的是
乙
乙
(填“甲”或“乙”);判断的理由是甲同学忽略了煤转化为水煤气要吸收热量
甲同学忽略了煤转化为水煤气要吸收热量
.(3)将煤转化为水煤气作为燃料和煤直接燃烧相比有很多优点,请列举其中的两个优点
①减少污染 ②燃烧充分
①减少污染 ②燃烧充分
.(4)已知热化学方程式:
Mg(OH)2(s)=MgO(s)+H2O(g)△H1=+81.5kJ?mol-1
Al(OH)3(s)=
| 1 |
| 2 |
| 3 |
| 2 |
①Mg(OH)2和Al(OH)3起阻燃作用的主要原因是
Mg(OH)2和Al(OH)3受热分解时吸收大量的热,使环境温度下降;同时生成的耐高温、稳定性好的MgO、Al2O3覆盖在可燃物表面,阻燃效果更佳
Mg(OH)2和Al(OH)3受热分解时吸收大量的热,使环境温度下降;同时生成的耐高温、稳定性好的MgO、Al2O3覆盖在可燃物表面,阻燃效果更佳
.②等质量Mg(OH)2和Al(OH)3相比,阻燃效果较好的是
Mg(OH)2
Mg(OH)2
,原因是等质量的Mg(OH)2比Al(OH)3吸热多
等质量的Mg(OH)2比Al(OH)3吸热多
.分析:(1)先根据燃烧热写出热化学方程式,然后根据盖斯定律来解答;
(2)根据盖斯定律:化学反应不管是一步完成还是分几步完成,其反应热是相同的;也就是说,化学反应的反应热只与反应的始态和终态有关,与反应途径无关.即如果一个反应可以分几步进行,则各步反应的反应热之和与该反应一步完成时的反应热相同;根据煤转化为水煤气要吸收热量;
(3)增大可燃物与氧气的接触面积或增大氧气的浓度可以促进可燃物的燃烧;
(4)①根据Mg(OH)2和Al(OH)3受热分解的反应热及其氧化物的熔点分析;
②根据等质量的氢氧化物分解时吸收的热量相对大小分析.
(2)根据盖斯定律:化学反应不管是一步完成还是分几步完成,其反应热是相同的;也就是说,化学反应的反应热只与反应的始态和终态有关,与反应途径无关.即如果一个反应可以分几步进行,则各步反应的反应热之和与该反应一步完成时的反应热相同;根据煤转化为水煤气要吸收热量;
(3)增大可燃物与氧气的接触面积或增大氧气的浓度可以促进可燃物的燃烧;
(4)①根据Mg(OH)2和Al(OH)3受热分解的反应热及其氧化物的熔点分析;
②根据等质量的氢氧化物分解时吸收的热量相对大小分析.
解答:解:(1)①C(石墨,s)+O2(g)=CO2(g)△H=-393.5 kJ/mol,
②CO(g)+l/2O2(g)=CO2(g)△H=-283.0 kJ/mol,
③H2(g)+l/2O2(g)=H2O(l)△H=-285.8kJ/mol,
④H2O(g)=H2O(l)△H=-44.0kJ/mol,
根据盖斯定律,①-②-③+④得:C(石墨,s)+H2O(g)=CO(g)+H2(g)△H=+131.3kJ/mol,
故答案为:C(石墨,s)+H2O(g)=CO(g)+H2(g)△H=+131.3kJ/mol;
(2)化学反应不管是一步完成还是分几步完成,其反应热是相同的;也就是说,化学反应的反应热只与反应的始态和终态有关,与反应途径无关.即如果一个反应可以分几步进行,则各步反应的反应热之和与该反应一步完成时的反应热相同;煤转化为水煤气要吸收热量,
故答案为:乙;甲同学忽略了煤转化为水煤气要吸收热量;
(3)通过改变对煤粉的加工,使煤与空气的接触面积增大,燃烧更充分,减少污染物的排放,故答案为:①减少污染 ②燃烧充分;
(4)①Mg(OH)2和Al(OH)3受热分解时吸收大量的热,使环境温度下降,使环境稳定达到着火点以下,阻止了燃料的燃烧;且同时生成的耐高温、稳定性好的MgO、Al2O3覆盖在可燃物表面,使阻燃效果更佳,
故答案为:Mg(OH)2和Al(OH)3受热分解时吸收大量的热,使环境温度下降;同时生成的耐高温、稳定性好的MgO、Al2O3覆盖在可燃物表面,阻燃效果更佳;
②Mg(OH)2的吸热效率为:81.5kJ?mol-1/58g?mol-1=1.41 kJ?g-1;Al(OH)3的吸热效率为:87.7kJ?mol-1/78g?mol-1=1.12 kJ?g-1;
等质量的Mg(OH)2比Al(OH)3吸热多,所以阻燃效果较好的是Mg(OH)2,故答案为:Mg(OH)2;等质量的Mg(OH)2比Al(OH)3吸热多.
②CO(g)+l/2O2(g)=CO2(g)△H=-283.0 kJ/mol,
③H2(g)+l/2O2(g)=H2O(l)△H=-285.8kJ/mol,
④H2O(g)=H2O(l)△H=-44.0kJ/mol,
根据盖斯定律,①-②-③+④得:C(石墨,s)+H2O(g)=CO(g)+H2(g)△H=+131.3kJ/mol,
故答案为:C(石墨,s)+H2O(g)=CO(g)+H2(g)△H=+131.3kJ/mol;
(2)化学反应不管是一步完成还是分几步完成,其反应热是相同的;也就是说,化学反应的反应热只与反应的始态和终态有关,与反应途径无关.即如果一个反应可以分几步进行,则各步反应的反应热之和与该反应一步完成时的反应热相同;煤转化为水煤气要吸收热量,
故答案为:乙;甲同学忽略了煤转化为水煤气要吸收热量;
(3)通过改变对煤粉的加工,使煤与空气的接触面积增大,燃烧更充分,减少污染物的排放,故答案为:①减少污染 ②燃烧充分;
(4)①Mg(OH)2和Al(OH)3受热分解时吸收大量的热,使环境温度下降,使环境稳定达到着火点以下,阻止了燃料的燃烧;且同时生成的耐高温、稳定性好的MgO、Al2O3覆盖在可燃物表面,使阻燃效果更佳,
故答案为:Mg(OH)2和Al(OH)3受热分解时吸收大量的热,使环境温度下降;同时生成的耐高温、稳定性好的MgO、Al2O3覆盖在可燃物表面,阻燃效果更佳;
②Mg(OH)2的吸热效率为:81.5kJ?mol-1/58g?mol-1=1.41 kJ?g-1;Al(OH)3的吸热效率为:87.7kJ?mol-1/78g?mol-1=1.12 kJ?g-1;
等质量的Mg(OH)2比Al(OH)3吸热多,所以阻燃效果较好的是Mg(OH)2,故答案为:Mg(OH)2;等质量的Mg(OH)2比Al(OH)3吸热多.
点评:本题主要考查了盖斯定律的应用,镁、铝的重要化合物的性质,难度不大,能准确筛选有用信息是解本题的关键.

练习册系列答案
相关题目