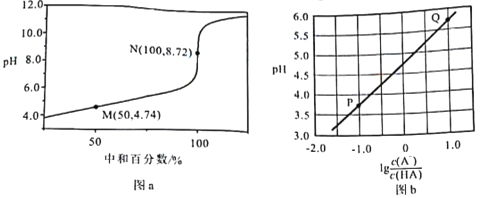
题目内容
【题目】室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.1mol·L-1的三种酸(HA、HB和HD)溶液,滴定的曲线如图所示,下列判断正确的是( )
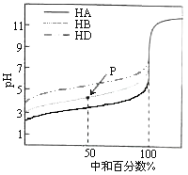
A.同浓度的三种盐溶液的pH:pH(NaA)>pH(NaB)>pH(NaD)
B.pH=7时,三种溶液中:c(A-)<c(B-)<c(D-)
C.滴定至P点时,溶液中:c(Na+)>c(B-)>c(HB)>c(H+)>c(OH-)
D.当中和百分数达100%时将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(OH-)-c(H+)
【答案】D
【解析】
A.室温下,相同浓度的这三种酸,酸的pH越小,酸的酸性越强,其电离平衡常数越大,根据图知,相同浓度的这三种酸,溶液的pH:HA>HB>HD, 则酸的电离平衡常数:K(HA)>K(HB)>K(HD),根据“越弱越水解”可知,相同温度下,同浓度的三种盐溶液的pH:pH(NaD)>pH(NaB)>pH(NaA),故A错误;
B.这几种酸的钠盐都是强碱弱酸盐,其水溶液都呈碱性,要使酸碱混合溶液呈中性,则酸应该稍微过量,酸的酸性越弱,其酸根离子水解程度越大,其钠盐溶液pH越大,要使混合溶液呈中性,则其酸碱混合溶液中越弱的酸剩余的应该越多,酸性:HA>HB>HD,则中性时剩余酸的量HA<HB<HD,所以溶液中c(A)>c(B)>c(D),故B错误;
C.P点,混合溶液呈酸性,则c(H+)>c(OH),因为中和50%,则溶液中具有等物质的量浓度的c(NaB)=c(HB),溶液呈酸性说明HB电离程度大于NaB水解程度,但是HB电离和NaB水解程度都较小,所以存在c(B)>c(Na+)>c(HB),则溶液中存在c(B)>c(Na+)>c(HB)>c(H+)>c(OH),故C错误;
D.当中和百分数达100%时,将三种溶液混合后,溶液中存在质子守恒,根据质子守恒得c(HA)+c(HB)+c(HD)+c(H+)=c(OH),所以得c(HA)+c(HB)+c(HD)=c(OH)c(H+),故D正确;
故选:D。

【题目】室温下进行的下列实验,不能达到预期目的的是( )
序号 | 实验内容 | 实验目的 |
A | 测定NaClO溶液、CH3COONa溶液的pH | 比较HClO和CH3COOH的酸性强弱 |
B | 向Mg(OH)2浊液中滴加少量0.1mol/LFeCl3溶液 | 比较Mg(OH)2和Fe(OH)3的溶解度 |
C | 将两个完全相同且充满NO2的密闭烧瓶,分别浸泡于热水、冰水中 | 探究温度对该化学平衡状态的影响 |
D | 向两只同体积同浓度的K2Cr2O7溶液中,分别加入1mL同浓度的H2SO4、NaOH溶液 | 探究浓度对该化学平衡状态的影响 |
A.AB.BC.CD.D
【题目】现使用酸碱中和滴定法测定市售白醋的浓度。
Ⅰ.实验步骤:
(1)用酸式滴定管取待测白醋溶液20.00 mL于锥形瓶中,向其中滴加2滴_____作指示剂。
(2)读取盛装0.1000 mol/L NaOH溶液的碱式滴定管的初始读数。如果液面位置如图所示,则此时的读数为________mL。
![]()
(3)滴定。当__________时,停止滴定,并记录NaOH溶液的终读数。重复滴定3次。
Ⅱ.实验记录
1 | 2 | 3 | 4 | |
V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
Ⅲ.数据处理与讨论:
(1)数据处理可得c(市售白醋)=_____mol/L。
(2)在本实验的滴定过程中,下列操作会使实验结果偏大的是_____(填写字母)。
A.碱式滴定管在滴定时未用标准NaOH溶液润洗
B.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
C.锥形瓶中加入待测白醋溶液后,再加少量水
D.滴定终点读数时俯视读数