题目内容
(6分)现有0.270kg质量分数为10%的CuCl2溶液。计算:
(1)溶液中CuCl2的物质的量;
(2)溶液中Cu2+和Cl-的物质的量。
(1)溶液中CuCl2的物质的量;
(2)溶液中Cu2+和Cl-的物质的量。
(1)0.2mol (2)0.2mol, 0.4mol
考查物质的量的有关计算
(1)0.270kg质量分数为10%的CuCl2溶液中含有溶质的质量是
0.27kg×10%=0.027kg=27.0g
氯化铜的摩尔质量是135g/mol
根据n=m/M可知
氯化铜的物质的量是27.0g÷135g/mol=0.2mol
(2)氯化铜在溶液中的电离方程式是CuCl2=Cu2+2Cl-
所以溶液中Cu2+和Cl-的物质的量分别是0.2mol和0.2mol×2=0.4mol
(1)0.270kg质量分数为10%的CuCl2溶液中含有溶质的质量是
0.27kg×10%=0.027kg=27.0g
氯化铜的摩尔质量是135g/mol
根据n=m/M可知
氯化铜的物质的量是27.0g÷135g/mol=0.2mol
(2)氯化铜在溶液中的电离方程式是CuCl2=Cu2+2Cl-
所以溶液中Cu2+和Cl-的物质的量分别是0.2mol和0.2mol×2=0.4mol

练习册系列答案
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案
相关题目
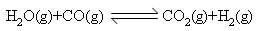 ,达到平衡后,测得CO2物质的量为0.75mol,再通入6mol水蒸气,达到新的平衡后,CO2和H2的物质的量之和为
,达到平衡后,测得CO2物质的量为0.75mol,再通入6mol水蒸气,达到新的平衡后,CO2和H2的物质的量之和为