题目内容
【题目】乙酸是生物油的主要成分之一,乙酸制氢具有重要意义:
热裂解反应CH3COOH(g)→2CO(g)+2H2(g) △H=+2l3.7KJ·mol-1
脱酸基反应CH3COOH(g)→CH4(g)+CO2(g) △H=-33.5KJ·mol-1
(1)请写出CO与H2甲烷化的热化学方程式_________________________________。
(2)在密闭容器中,利用乙酸制氢,选择的压强为___________(填“较大”或“常压”)。其中温度与气体产率的关系如图:
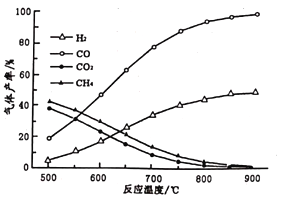
①约650℃之前,脱酸基反应活化能低速率快,故氢气产率低于甲烷;650℃之后氢气产率高于甲烷,理由是随着温度升高后,热裂解反应速率加快,同时______________________。
②保持其他条件不变,在乙酸气中掺杂一定量水,氢气产率显著提高而CO的产率下降,请用化学方程式表示:_________________________________。
(3)若利用合适的催化剂控制其他的副反应,温度为TK时达到平衡,总压强为PkPa,热裂解反应消耗乙酸20%,脱酸基反应消耗乙酸60%,乙酸体积分数为___________(计算结果保留l位小数);脱酸基反应的平衡常数Kp为___________kPa(Kp为以分压表示的平衡常数,计算结果保留1位小数)。
【答案】2CO(g) +2H2(g)→ CH4(g) + CO2 (g) H= 247.2 KJ·mol-1 常压 热裂解反应正向移动,而脱酸基反应逆向移动,故氢气产率高于甲烷 CO(g) +H2O(g) ═ H2(g) + CO2 (g) 9.1% 0.8P
【解析】
(1)由盖斯定律计算;
(2)在密闭容器中,利用乙酸制氢,CH3COOH(g)→2CO(g)+2H2(g) ,反应为气体体积增大的反应,选择的压强为常压。
①热裂解反应CH3COOH(g)→2CO(g)+2H2(g) 是吸热反应,热裂解反应正向移动,脱酸基反应CH3COOH(g)→CH4(g)+CO2(g) 是放热反应,而脱酸基反应逆向移动。
②CO能与水蒸反应生成二氧化碳和氢气。
(3)根据体积分数的定义计算;根据平衡常数Kp的定义计算。
(1)由盖斯定律计算:①热裂解反应CH3COOH(g)→2CO(g)+2H2(g) △H=+2l3.7KJ·mol-1,②脱酸基反应CH3COOH(g)→CH4(g)+CO2(g) △H=-33.5KJ·mol-1,②-①得:CO与H2甲烷化的热化学方程式 2CO(g) +2H2(g)→ CH4(g) + CO2 (g) H= 247.2 KJ·mol-1;
(2)在密闭容器中,利用乙酸制氢,CH3COOH(g)→2CO(g)+2H2(g) ,反应为气体体积增大的反应,选择的压强为常压。
①热裂解反应CH3COOH(g)→2CO(g)+2H2(g) 是吸热反应,热裂解反应正向移动,脱酸基反应CH3COOH(g)→CH4(g)+CO2(g) 是放热反应,而脱酸基反应逆向移动。650℃之后氢气产率高于甲烷,理由是随着温度升高后,热裂解反应速率加快,同时①热裂解反应正向移动,而脱酸基反应逆向移动,故氢气产率高于甲烷。
②CO能与水蒸反应生成二氧化碳和氢气,在乙酸气中掺杂一定量水,氢气产率显著提高而CO的产率下降,CO(g) +H2O(g) ═ H2(g) + CO2 (g) 。
(3)热裂解反应CH3COOH(g)→2CO(g)+2H2(g) △H=+2l3.7KJ·mol-1
0.2 0.4 0.4
脱酸基反应CH3COOH(g)→CH4(g)+CO2(g) △H=-33.5KJ·mol-1
0.6 0.6 0.6
乙酸体积分数为0.2/(0.4+0.4+0.6+0.6+0.2)×100%=9.1%
Kp=p(CH4)p(CO2)/p(CH3COOH)=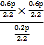 =0.8P.
=0.8P.

【题目】下列实验“操作和现象”与“结论”对应关系正确的是![]()
操作和现象 | 结论 | |
A | 常温下,将Al箔插入浓 | 铝和浓硝酸不反应 |
B | 向饱和 | 析出了 |
C | 用铂丝蘸取溶液进行焰色反应,观察到火焰呈黄色 | 该溶液一定是钠盐溶液 |
D | 向装有 |
|
A.AB.BC.CD.D
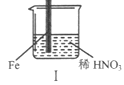
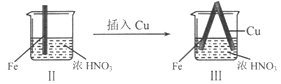
【题目】在通风橱中进行下列实验:
步骤 |
|
| |
现象 | Fe表面产生大量无色气泡,液面上方变为红棕色 | Fe表面产生少量红棕色气泡后,迅速停止 | Fe、Cu接触后,其表面均产生红棕色气泡 |
下列说法不正确的是
A. I中气体由无色变红棕色的化学方程式:2NO+O2=2NO2
B. II中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应
C. 对比I、II中现象,说明稀HNO3的氧化性强于浓HNO3
D. 针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否被氧化
【题目】汽车发动机工作时会产生包括CO、NOx等多种污染气体,涉及到如下反应:
①N2(g)+O2(g)![]() 2NO(g)
2NO(g)
②2NO(g)+O2(g)![]() 2NO2(g)
2NO2(g)
③NO2(g)+CO(g)![]() CO2(g)+NO(g)
CO2(g)+NO(g)
弄清上述反应的相关机理,对保护大气环境意义重大,回答下列问题:
科学家研究出了一种高效催化剂,可以将CO和NO2两者转化为无污染气体,反应方程式为:2NO2(g)+4CO(g)=4CO2(g)+N2(g) △H<0
某温度下,向10L密闭容器中分别充入0.1molNO2和0.2molCO,发生上述反应,随着反应的进行,容器内的压强变化如表所示:
时间/min | 0 | 2 | 4 | 6 | 8 | 10 | 12 |
压强/kPa | 75 | 73.4 | 71.95 | 70.7 | 69.7 | 68.75 | 68.75 |
回答下列问题:
若将温度降低,再次平衡后,与原平衡相比体系压强(p总)如何变化?___(填“增大”、“减小”或“不变”),原因是____。