题目内容
在150℃时使NH4HCO3分解,将所产生的气体依次通过Na2O2和浓H2SO4,则Na2O2增重a g,浓H2SO4增重b g;若将上述气体先通过浓H2SO4,则使酸液增重dg,再通过Na2O2,则使之增重c g.设气体皆完全被吸收,a、b、c、d质量由大到小的排列顺序正确的是( )
分析:碳酸氢铵受热分解产生水、氨气和二氧化碳三种气体,过氧化钠增质量为二氧化碳或水的质量减去生成的氧气的质量,浓硫酸吸收多少氨气或水,质量就增加多少.
解答:解:碳酸氢铵受热分解产生水、氨气和二氧化碳三种气体,分解产生水、氨气和二氧化碳三种气体质量比为18:17:44,
若将生成物全部依次通过足量过氧化钠和足量浓硫酸时,过氧化钠增重ag,浓硫酸增重bg,过氧化钠增重ag为二氧化碳以及水的总量减去氧气的量,根据反应方程式:2Na2O2+2CO2═2Na2CO3+O2↑,过氧化钠质量增加0.5×(88g-32g)=28g,2Na2O2+2H2O═4NaOH+O2↑,过氧化钠质量增加0.5×(36g-32g)=2g,a=30g.
浓硫酸增重bg为氨气,即b=17g;
若将生成物全部依次通过足量浓硫酸和过氧化钠时,过氧化钠增重cg,浓硫酸增重dg,过氧化钠增重cg为二氧化碳的总量减去氧气的量,根据反应方程式:2Na2O2+2CO2═2Na2CO3+O2↑,过氧化钠质量增加0.5×(88g-32g)=28g,即c=28g;
浓硫酸增重dg为分解产生的所有水及氨气,即d=35;
所以d>a>c>b,
故选A.
若将生成物全部依次通过足量过氧化钠和足量浓硫酸时,过氧化钠增重ag,浓硫酸增重bg,过氧化钠增重ag为二氧化碳以及水的总量减去氧气的量,根据反应方程式:2Na2O2+2CO2═2Na2CO3+O2↑,过氧化钠质量增加0.5×(88g-32g)=28g,2Na2O2+2H2O═4NaOH+O2↑,过氧化钠质量增加0.5×(36g-32g)=2g,a=30g.
浓硫酸增重bg为氨气,即b=17g;
若将生成物全部依次通过足量浓硫酸和过氧化钠时,过氧化钠增重cg,浓硫酸增重dg,过氧化钠增重cg为二氧化碳的总量减去氧气的量,根据反应方程式:2Na2O2+2CO2═2Na2CO3+O2↑,过氧化钠质量增加0.5×(88g-32g)=28g,即c=28g;
浓硫酸增重dg为分解产生的所有水及氨气,即d=35;
所以d>a>c>b,
故选A.
点评:本题主要考查学生铵盐受热易分解的性质、过氧化钠与水及二氧化碳的反应性质方面的知识,注重了差量法在解题中的应用,难度较大.

练习册系列答案
相关题目
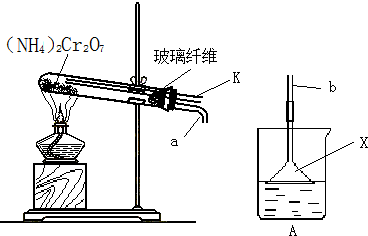
(16分)重铬酸铵 [(NH4)2Cr2O7]是一种橘黄色的晶体,常用于石油精炼、制革、印染、烟火、陶瓷等行业,是一种重要的化工原料。
(1)已知在酸性条件下,重铬酸盐有强氧化性。向冷的酸性重铬酸铵溶液中通入H2S,可得到Cr3+和S,写出反应的离子方程式: 。
(2)在150℃时,重铬酸铵迅速呈膨胀式分解,发生如下主要反应:
 |
(NH4)2Cr2O7=Cr2O3+4H2O+N2↑,
但同时要发生副反应。某同学设计了如下装置,探究副反应的生成物:
①装置中棉花的作用是 ;加热前,该同学先通过导管K向试管中通一会N2,其目的是 ;
②连接a、b,关闭导管K,加热使反应发生。若装置A中所盛溶液为酚酞溶液,且溶液变红,说明有 产生,仪器X的作用是 ;若装置A中所盛溶液为新制的硫酸亚铁溶液,且出现棕红色的沉淀,说明副反应中有 产生,写出产生该沉淀的离子方程式 。