题目内容
【题目】(1)氨气可作为脱硝剂,在恒温恒容密闭容器中充入一定量的 NO 和 NH3,在 一定条件下发生反应:6NO(g) + 4NH3(g)![]() 5N2(g) +6H2O(g)。
5N2(g) +6H2O(g)。
①能说明该反应已达到平衡状态的标志是 ___________
a.反应速率 v( NH3) =v( N2)
b.容器内压强不再随时间而发生变化
c.容器内 N2 的物质的量分数不再随时间而发生变化
d.容器内 n(NO)∶n(NH3)∶n(N2)∶n(H2O) = 6∶4∶5∶6
e.12molN-H 键断裂的同时生成 5mol N≡N 键
f.混合气体的总质量不随时间的变化而变化
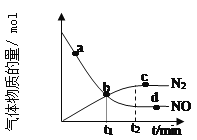
②某次实验中测得容器内 NO 及 N2 的物质的量随时间变化如图所示,图中 b 点 对应的速率关系是v(正) ___________ v(逆)(填﹥、﹤或﹦),d 点对应的速率关系是v(正) ___________ v(逆)
(填﹥、﹤或﹦)。
(2)298 K 时,若已知生成标准状况下 2.24LNH3时放出热量为 4.62kJ。写出合成氨反应的热化学方程式___________。在该温度下,取 1molN2和 3mol H2 放在一密闭容器中,在催化剂存在时进行反应。测得反应放出的热量总小于 92.4 kJ, 其原因是___________。
(3)一定条件下,在 2L密闭容器内,反应 2NO2(g)![]() N2O4(g) ΔH=-180 kJ·mol-1,n(NO2)随时间变化如下表:
N2O4(g) ΔH=-180 kJ·mol-1,n(NO2)随时间变化如下表:
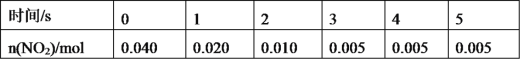
①用 N2O4 表示 0~2 s 内该反应的平均速率为__________。在第 5s 时,NO2 的转化 率为____________。(转化率是指某一反应物转化的百分率。)
②根据上表可以看出,随着反应进行,反应速率逐渐减小,其原因是______________。
【答案】bc > = N2(g)+3H2(g)2NH3(g) △H=-92.4kJ/mol 该反应是可逆反应,1molN2和3molH2不可能完全反应,所以放出的热量总是小于92.4kJ 0.00375molL-1s-1 87.5% 随着反应的进行,二氧化氮的物质的量浓度减小,反应速率减小
【解析】
(1)①根据化学平衡状态的特征分析判断;②根据图象,结合化学平衡的建立和达到平衡时ν(正)与ν(逆)相等判断。
(2)每生成2.24L氨气,同时放出4.62kJ的热量,据此计算生成2mol氨气放出的热量,在写出热化学方程式,结合可逆反应的特征分析解答;
(3)结合v=![]() 结合化学反应速率之比等于化学计量数之比计算反应速率,并根据浓度对反应速率的影响分析解答。
结合化学反应速率之比等于化学计量数之比计算反应速率,并根据浓度对反应速率的影响分析解答。
(1)①a.该反应达到平衡状态时,5v(NH3)正=4v(N2)逆,v( NH3) =v( N2),不能判断正逆反应速率的关系,故a错误;b.该反应是一个反应前后气体体积增大的可逆反应,当反应达到平衡状态时,容器内压强不随时间的变化而变化,所以能判断反应是否达到平衡状态,故b正确;c.容器内N2的物质的量分数不再随时间而发生变化,说明N2浓度不再改变,能判断达到平衡状态,故c正确;d.容器内 n(NO)∶n(NH3)∶n(N2)∶n(H2O) = 6∶4∶5∶6,不能说明浓度是否发生变化,不能判断达到平衡状态,故d错误;e.12molN-H 键断裂的同时一定会生成 5mol N≡N 键,都表示正反应速率,不能判断达到平衡状态,故e错误;f.反应前后都是气体,混合气体的总质量始终不变,混合气体的总质量不随时间的变化而变化,不能判断达到平衡状态,故f错误;故答案为:bc;
②图中b点没有达到平衡,反应仍在正向进行,所以图中b点对应的速率关系是v(正)>v(逆);d点达到平衡状态,ν(正)=ν(逆)相等,故答案为:>;=;
(2) 标准状况下,2.24LNH3的物质的量=![]() =0.1mol,放出4.62kJ的热量,则生成2mol氨气放热
=0.1mol,放出4.62kJ的热量,则生成2mol氨气放热![]() ×4.62kJ=92.4kJ,反应的热化学方程式为:N2(g)+3H2(g)2NH3(g) △H=-92.4kJ/mol,合成氨的反应是可逆反应,△H=-92.4kJ/mol是1molN2和3molH2完全反应放出的热量,因此将1molN2和3molH2在此条件下反应,放出的热量一定小于92.4kJ,故答案为:N2(g)+3H2(g)2NH3(g) △H=-92.4kJ/mol;该反应是可逆反应,1molN2和3molH2不可能完全反应,所以放出的热量总是小于92.4kJ;
×4.62kJ=92.4kJ,反应的热化学方程式为:N2(g)+3H2(g)2NH3(g) △H=-92.4kJ/mol,合成氨的反应是可逆反应,△H=-92.4kJ/mol是1molN2和3molH2完全反应放出的热量,因此将1molN2和3molH2在此条件下反应,放出的热量一定小于92.4kJ,故答案为:N2(g)+3H2(g)2NH3(g) △H=-92.4kJ/mol;该反应是可逆反应,1molN2和3molH2不可能完全反应,所以放出的热量总是小于92.4kJ;
(3)①用NO2表示0~2s内该反应的平均速度为 =0.0075molL-1s-1;则用 N2O4 表示 0~2 s 内该反应的平均速率为
=0.0075molL-1s-1;则用 N2O4 表示 0~2 s 内该反应的平均速率为![]() ×0.0075molL-1s-1=0.00375molL-1s-1,在第5s时,NO2的转化率为
×0.0075molL-1s-1=0.00375molL-1s-1,在第5s时,NO2的转化率为![]() ×100%=87.5%,故答案为:0.00375molL-1s-1;87.5%;
×100%=87.5%,故答案为:0.00375molL-1s-1;87.5%;
②根据上表可以看出,随着反应进行,反应速率逐渐减小,其原因是随着反应的进行,二氧化氮的物质的量浓度减小,反应速率减小,故答案为:随着反应的进行,二氧化氮的物质的量浓度减小,反应速率减小。

 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案