题目内容
4.工业上可用电解饱和食盐水来制取氯气,反应方程式如下:2NaCl+2H2O 电解_ 2NaOH+H2↑+Cl2↑(1)用双线桥法标明下列氧化还原反应中电子转移的方向和数目

(2)在该反应中,氧化剂是H2O
(3)在标况下,当有2.24L氯气生成时,有0.2mol电子发生转移.
分析 该反应中,氯元素化合价由-1价变为0价,氢元素化合价由+1价变为0价,所以氯化钠失电子,水得电子,所以电子从氯化钠转移到水,结合元素化合价的变化判断相关概念和 电子转移数目的计算.
解答 解:(1)电解氯化钠溶液时,生成1mol氯气需要2mol电子,生成1mol氢气需要2mol电子,所以其转移电子数是2,电子转移方向和数目为 ,故答案为:
,故答案为: ;
;
(2)反应中H元素化合价降低,则H2O为氧化剂,故答案为:H2O;
(3)反应中Cl元素化合价由-1价升高到0价,则当有2.24L氯气生成时,即生成氯气0.1mol,则转移0.2mol电子,故答案为:0.2.
点评 本题考查氧化还原反应,侧重于学生的分析能力的考查,为高考常见题型和高频考点,注意从元素化合价的角度分析,能用双线桥标出电子转移的方向和数目,难度不大.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
15.下列物质的水溶液能导电,但属于非电解质的是( )
| A. | 食盐水 | B. | CO2 | C. | NaHCO3 | D. | 氢氧化钠 |
12.“绿色化学”是当今社会提出的一个新概念.在“绿色化学工艺中,理想状态是反应物中原子全部转化为欲制的产物,即原子的利用率为100%.在用丙炔合成甲基丙烯酸甲酯( )的过程中,欲使原子利用率达到最高,还需要其他的反应物是( )
| A. | CO和CH3OH | B. | CO2和H20 | C. | H2和CO2 | D. | CH3OH和H2 |
9.下列反应中,水只作氧化剂的是( )
| A. | Cl2+H2O═HCl+HClO | B. | 2Na2O2+2H2O═4NaOH+O2↑ | ||
| C. | 2Na+2H2O═4NaOH+H2↑ | D. | 2H2O═2H2↑+O2↑ |
16.用X、Y、Z、w四种金属进行如下实验:
根据以上事实.下列判断或推测错误的是( )
| 1 | 将X与Y用导线连接,浸入电解质溶液中,Y极上有气泡产生 |
| 2 | 将片状X、W分别投入等浓度的稀盐酸中都有气体产生,W比X反应剧烈 |
| 3 | 用惰性电极电解等物质的量浓度的Y和Z的硝酸盐混合溶液,在阴极上首先析出Z |
| A. | 上述四种金属中,Z的单质还原性最弱 | |
| B. | w的还原性强于Y的还原性 | |
| C. | Z放人CuSO4溶液中一定有Cu析出 | |
| D. | 用X、Z和稀硫酸可构成原电池,X作负极 |
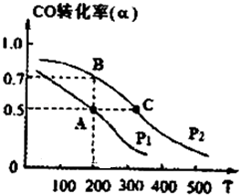 工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2 (g)?CH3OH (g)△H=-116kJ/mol
工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2 (g)?CH3OH (g)△H=-116kJ/mol