题目内容
(6分)已知2X2(g)+Y2(g) 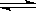 2Z(g) ΔH=-akJ·mol-1(a>0),在一个容积固定的容器中加入2mol X2和1mol Y2在500℃时充分反应达平衡后Z的浓度为W mol·L-1,放出热量b kJ。
2Z(g) ΔH=-akJ·mol-1(a>0),在一个容积固定的容器中加入2mol X2和1mol Y2在500℃时充分反应达平衡后Z的浓度为W mol·L-1,放出热量b kJ。
⑴此反应平衡常数表达式为____________ _;若将温度降低到300℃,则反应平衡常数将_____(填增大、减少或不变)。
⑵若原来容器中只加入2mol Z,500℃充分反应达平衡后,吸收热量c kJ,则Z浓度_______Wmol·L—1(填“>”、“<”或“=”),a、b、c之间满足关系______ _____(用代数式表示)。
⑶能说明反应已达平衡状态的是___________________。
| A.浓度c(Z)=2c(Y2) | B.容器内压强保持不变 |
| C.v逆(X2)=2v正(Y2) | D.容器内的密度保持不变 |
(12分,每空2分).⑴ K=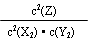 ;增大 ⑵=;a =" b" + c ⑶BC (4)变大
;增大 ⑵=;a =" b" + c ⑶BC (4)变大
解析试题分析:(1)化学常数是在一定条件下的可逆反应中,当可逆反应反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以根据反应的方程式可知,该反应的平衡常数的表达式K=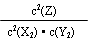 。正反应是放热反应,所以降低温度平衡向正反应方向移动,平衡常数增大。
。正反应是放热反应,所以降低温度平衡向正反应方向移动,平衡常数增大。
(2)2mol Z就相当于是2mol X2和1mol Y2,所以在温度和容器容积不变的情况下,两次平衡是等效的,因此Z的浓度仍然是Wmol·L—1。两次热效应的绝对值之和等于该反应的反应热,因此a=b+c。
(3)在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。平衡时浓度不再发生变化,但各物质的浓度之间不一定相等或满足某种关系,A不正确;反应前后体积减小,所以压强也是减小,因此压强不再变化时,可以说明达到平衡状态,B正确;C中反应速率的方向相反,且满足速率之比是相应的化学计量数之比,正确;密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,D不正确,所以答案选BC。
(4)由于反应是体积减小的,因此压强也是减小的。所以如果保持恒压,则有利于平衡向正反应方向移动,反应物的转化率将增大。
考点:考查平衡常数、平衡状态以及等效平衡的判断、外界条件对平衡状态的影响等
点评:所谓等效平衡是指外界条件相同时,同一可逆反应只要起始浓度相当,无论经过何种途径,都可以达到相同的平衡状态。等效平衡的判断及处理一般步骤是:进行等效转化——边倒法,即按照反应方程式的计量数之比转化到同一边的量,与题干所给起始投料情况比较。等效平衡一般有三种类型:I类:恒温恒容下对于反应前后气体体积发生变化的反应来说(即△n≠0的体系):等效转化后,对应各物质起始投料的物质的量与原平衡起始态相同。II类:恒温恒容下对于反应前后气体体积没有变化的反应来说(即△n=0的体系):等效转化后,只要反应物(或生成物)的物质的量的比例与原平衡起始态相同,两平衡等效。III类:恒温恒压下对于气体体系等效转化后,要反应物(或生成物)的物质的量的比例与原平衡起始态相同,两平衡等效。解答该类型试题的关键是分清类别,用相应的方法求解即可。

 阅读快车系列答案
阅读快车系列答案
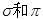 键的键数之比为 ,其化学性质 (填“活泼”或“稳定”):
键的键数之比为 ,其化学性质 (填“活泼”或“稳定”):
 键的键数之比为 ,其化学性质
(填“活泼”或“稳定”):
键的键数之比为 ,其化学性质
(填“活泼”或“稳定”):