题目内容
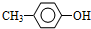
1.一种有机物的结构简式如图,关于它的性质不正确的说法是( )
| A. | 它有酸性,1 mol该物质最多能与6 mol H2发生加成反应 | |
| B. | 它可以水解,水解产物为两种有机物 | |
| C. | 在一定条件下,1 mol该物质最多能和8 mol NaOH反应 | |
| D. | 该有机物能发生取代反应 |
分析 有机物含有酚羟基,可发生取代、氧化和显色反应,含有酯基,可发生水解反应,含有羧基,具有酸性,可发生中和和酯化反应,以此解答该题.
解答 解:A.分子中含有2个苯环,则1mol该物质最多能与6mol H2发生加成反应,故A正确;
B.含-COOC-,能水解,但由结构可知,水解产物只有一种,故B错误;
C.酚-OH、-COOH、-COOC-,均与NaOH反应,则1 mol该有机物最多能和8mol NaOH反应,故C正确;
D.有机物含有羟基、酯基、羧基,可都发生取代反应,故D正确.
故选B.
点评 本题考查有机物的结构与性质,为高考常见题型,注意把握结构中官能团及性质的关系,熟悉酚、羧酸、酯的性质即可解答,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
11.如图为原子结构模型的演变图,其中 (1)为道尔顿原子模型(4)为近代量子力学原子模型符合历史演变顺序的一组排列是( )


| A. | (1)(3)(2)(5)(4) | B. | (1)(2)(3)(4)(5) | C. | (1)(5)(3)(2)(4) | D. | (1)(3)(5)(4)(2) |
9.常温下,PH=2的H2SO4溶液中,水电离出的H+的浓度是( )
| A. | 5×10-13mol•L-1 | B. | 0.02 mol•L-1 | C. | 1×10-2 mol•L-1 | D. | 1×10-12 mol•L-1 |
16.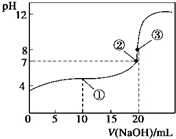 常温下,用0.1000mol•L-1 NaOH溶液滴定20.00mL 0.1000mol•L-1 CH3COOH溶液所得滴定曲线如图.下列说法正确的是( )
常温下,用0.1000mol•L-1 NaOH溶液滴定20.00mL 0.1000mol•L-1 CH3COOH溶液所得滴定曲线如图.下列说法正确的是( )
 常温下,用0.1000mol•L-1 NaOH溶液滴定20.00mL 0.1000mol•L-1 CH3COOH溶液所得滴定曲线如图.下列说法正确的是( )
常温下,用0.1000mol•L-1 NaOH溶液滴定20.00mL 0.1000mol•L-1 CH3COOH溶液所得滴定曲线如图.下列说法正确的是( )| A. | ①所示溶液中:c(Na+)═c(CH3COOH)+c(CH3COO-) | |
| B. | ②所示溶液中:c(Na+)═c(CH3COO-) | |
| C. | ③所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) | |
| D. | 滴定过程中可能出现:c(CH3COO-)>c(Na+)>c(OH-)>c(H+) |
6.有关胶体的说法正确的是( )
| A. | 胶体都带电荷,因而都有电泳现象 | |
| B. | 鉴别胶体和溶液可用渗析法 | |
| C. | 血清透析和制豆腐利用胶体的性质相同 | |
| D. | 胶体的胶粒直径在1nm~100nm之间 |
10.下列说法中有明显错误的是( )
| A. | 对有气体参加的化学反应,增大压强体系体积减小,可使单位体积内活化分子数增加,因而反应速率增大 | |
| B. | 升高温度,一般可使活化分子的百分数增大,因而反应速率增大 | |
| C. | 加入适宜的催化剂,可使活化分子的百分数大大增加,从而成千上万倍地增大化学反应的速率 | |
| D. | 所有自发进行的化学反应都是放热反应 |
5.在100℃时,将N2O4、NO2分别充入两个各为1L的密闭容器中,反应过程中浓度变化如下:(2NO2(g)?N2O4(g)△H<0)
下列说法正确的是( )
| 容器 | 物质 | 起始浓度/(mol•L-1) | 平衡浓度/(mol•L-1) |
| Ⅰ | N2O4 | 0.100 | 0.040 |
| NO2 | 0 | 0.120 | |
| Ⅱ | N2O4 | 0 | 0.014 |
| NO2 | 0.100 | 0.072 |
| A. | 平衡时,Ⅰ、Ⅱ中反应物的转化率α(N2O4)<α(NO2) | |
| B. | 平衡时,Ⅰ、Ⅱ中上述正反应的平衡常数K(Ⅰ)=2K(Ⅱ) | |
| C. | 平衡后,向两容器中分别再充入一定量的NO2,(Ⅰ)中$\frac{c({N}_{2}{O}_{4})}{c(N{O}_{2})}$的值减小,(Ⅱ)$\frac{c({N}_{2}{O}_{4})}{c(N{O}_{2})}$ 的值增大 | |
| D. | 平衡后,升高温度,Ⅰ、Ⅱ中气体颜色都将变深 |
 .
.