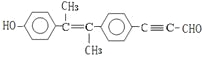
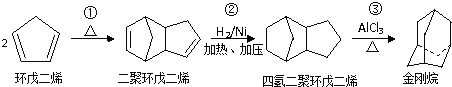
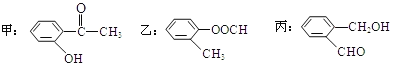
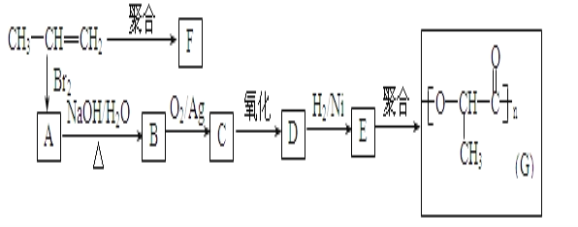
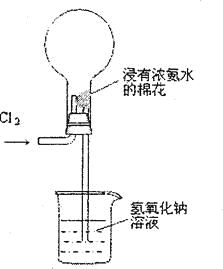
题目内容
【题目】为了将可称量的物质与难以称量的微观粒子之间联系起来,国际上采用了“物质的量”这一物理量,据此完成下列试题:
(1)等质量的O2和O3所含分子的物质的量之比为___。
(2)等温等压下,等体积的O2和O3所含分子个数比为___,质量比为___。
(3)设NA为阿伏加德罗常数的值,如果ag氧气中含有的分子数为b,则cg氧气在标准状况下的体积约是___(用含a、b、c、NA的式子表示)。
(4)实验室需要配制100mL1mol/L的NaOH溶液,进行如下操作:
①配制该溶液所需主要仪器除了托盘天平、玻璃棒、烧杯、胶头滴管,还需要的玻璃仪器___。
②计算需要NaOH固体的质量:___g。
③取出50 mL配制好的溶液,此溶液中NaOH的物质的量浓度为___。
④若出现如下情况,导致所配溶液浓度偏高的是___。
A.称量时砝码已经生锈
B.定容时仰视
C.溶解、转移溶液之后没有对烧杯和玻璃棒进行洗涤操作
D.定容摇匀后,液面低于容量瓶颈上的刻度线
【答案】3:2 1:1 2:3 ![]() L 100mL容量瓶 4.0 1mol/L A
L 100mL容量瓶 4.0 1mol/L A
【解析】
(1)根据![]() 可知,等质量的O2和O3的物质的量之比为
可知,等质量的O2和O3的物质的量之比为![]() ,所含分子的物质的量之比为3:2。
,所含分子的物质的量之比为3:2。
(2)根据阿伏加德罗定律,PV=nRT(R为常数),在等温等压下,等体积的任一气体所含分子的物质的量相同,由N=nNA(NA为常数)可知,分子个数比为1:1;由m=nM 可知,O2和O3的质量比为2:3。
(3)设NA为阿伏加德罗常数的值,如果ag氧气中含有的分子数为b,则ag氧气的物质的量![]() ,摩尔质量
,摩尔质量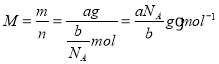 ,即当氧气为cg,物质的量
,即当氧气为cg,物质的量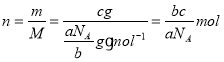 ,在标准状况下的体积
,在标准状况下的体积![]() L。
L。
(4)①实验室需要配制100mL1mol/L的NaOH溶液,则配制该溶液所需主要仪器为托盘天平、玻璃棒、烧杯、胶头滴管和100mL容量瓶 。
②需要NaOH固体的质量![]() 。
。
③溶液具有均一性,物质的量浓度不随着溶液的体积发生改变,浓度仍然为1mol/L。
④A.称量时砝码已经生锈,实际砝码质量增大,称得的氢氧化钠质量增大,浓度偏高;
B.定容时仰视,实际加水量偏高,溶液浓度偏低;
C.溶解、转移溶液之后没有对烧杯和玻璃棒进行洗涤操作,剩余部分溶质残留,导致容量瓶内部溶质减小,溶液物质的量浓度偏低;
D.定容摇匀后,溶液物质的量浓度固定,液面低于容量瓶颈上的刻度线对结果无影响。
答案为A。

【题目】某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯。
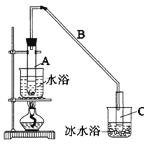
已知: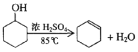
密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
环已醇 | 0.96 | 25 | 161 | 能溶于水 |
环已烯 | 0.81 | -103 | 83 | 难溶于水 |
(1)制备粗品
将12.5mL环己醇加入试管A中,再加入lmL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是:_______________,导管B除了导气外还具有的作用是:_______________。
②试管C置于冰水浴中的目的是。:_______________
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在:_______________层(填上或下),分液后用:_______________ (填入编号)洗涤。
a.KMnO4溶液b.稀H2SO4c.Na2CO3溶液