题目内容
【题目】在标准状况下,将aLNH3完全溶于水得到VmL氨水,溶液的密度为ρg/cm3,溶质的质量分数为ω,溶质的物质的量浓度为cmol/L。下列叙述中正确的是()
①![]()
② ![]()
③ 若上述溶液中再加入VmL水后,所得溶质的质量分数大于0.5ω
④ 若上述溶液中再加入0.5mL同浓度稀盐酸,充分反应后溶液中离子浓度大小关系为:
c(NH4+)>c(Cl-)>c(OH-)>c(H+)
A.①④ B.②③ C.②④ D.①③
【答案】C
【解析】
试题分析:①氨气溶于水,主要以NH3H2O存在,但仍然以NH3作为溶质,ω=![]() ×100% =
×100% =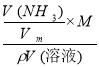 =
=![]() ×100%,故①错误;②C=
×100%,故①错误;②C=![]() =
=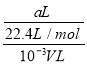 =
= ![]() mol/L,故②正确;③溶质质量分数=
mol/L,故②正确;③溶质质量分数=![]() ×100%=
×100%=![]() ×100%=
×100%=![]() <0.5ω,故③错误;④盐酸的物质的量小于氨水的物质的量,所以该溶液呈碱性,溶液中氢氧根离子浓度大于氢离子的浓度,铵根离子的浓度大于氯离子的浓度,所以大小顺序为c(NH4+)>c(Cl-)>c(OH-)>c(H+),故④正确;故选C。
<0.5ω,故③错误;④盐酸的物质的量小于氨水的物质的量,所以该溶液呈碱性,溶液中氢氧根离子浓度大于氢离子的浓度,铵根离子的浓度大于氯离子的浓度,所以大小顺序为c(NH4+)>c(Cl-)>c(OH-)>c(H+),故④正确;故选C。

 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
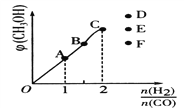
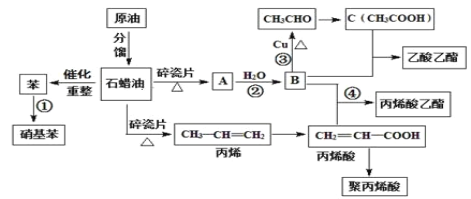
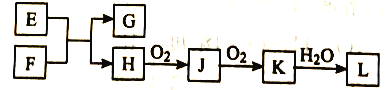
金博士一点全通系列答案【题目】BE是现代有机化工重要的单体之一,工业上采取乙苯催化脱氢制苯乙烯反应制备:
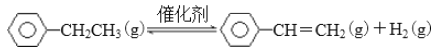
(1)已知:
化学键 | C-H | C-C | C=C | H-H |
键能/ | 412 | 348 | 612 | 436 |
计算上述反应的![]() _______
_______![]() 。该反应能够发生的原因是______
。该反应能够发生的原因是______
(2)维持体系总压强p恒定,在温度T时,物质的量为n、体积为V的乙苯蒸汽发生催化脱氢反应。已知乙苯的平衡转化率为![]() ,则在该温度下反应的平衡常数K=_______(用a等符号表示)。
,则在该温度下反应的平衡常数K=_______(用a等符号表示)。
(3)工业上,通常在乙苯蒸气中掺混水蒸气,控制反应温度600℃,并保持体系总压为常压的条件下进行反应。在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了![]() 以外的产物中苯乙烯的物质的量分数)示意图如图所示:
以外的产物中苯乙烯的物质的量分数)示意图如图所示:

a.掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实__________。
b.控制反应温度为![]() 的理由是___________
的理由是___________
(4)在逆过程苯乙烯加氢制乙苯的操作中,如果氢气中混有![]() 和
和![]() 等杂质,会引起催化剂中毒,因此必须除去。在常温下,可以用银氨溶液来检测微量的
等杂质,会引起催化剂中毒,因此必须除去。在常温下,可以用银氨溶液来检测微量的![]() ,其原理与银镜反应相似,有银析出,写出银氨溶液与
,其原理与银镜反应相似,有银析出,写出银氨溶液与![]() 反应的离子方程式________________。
反应的离子方程式________________。
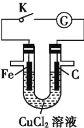
(5)苯乙烯废气在工业上常用电催化氧化处理,原理如图所示:

写出阳极电极反应式I为______________