题目内容
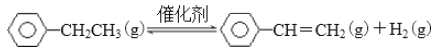
【题目】BE是现代有机化工重要的单体之一,工业上采取乙苯催化脱氢制苯乙烯反应制备:
(1)已知:
化学键 | C-H | C-C | C=C | H-H |
键能/ | 412 | 348 | 612 | 436 |
计算上述反应的![]() _______
_______![]() 。该反应能够发生的原因是______
。该反应能够发生的原因是______
(2)维持体系总压强p恒定,在温度T时,物质的量为n、体积为V的乙苯蒸汽发生催化脱氢反应。已知乙苯的平衡转化率为![]() ,则在该温度下反应的平衡常数K=_______(用a等符号表示)。
,则在该温度下反应的平衡常数K=_______(用a等符号表示)。
(3)工业上,通常在乙苯蒸气中掺混水蒸气,控制反应温度600℃,并保持体系总压为常压的条件下进行反应。在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了![]() 以外的产物中苯乙烯的物质的量分数)示意图如图所示:
以外的产物中苯乙烯的物质的量分数)示意图如图所示:
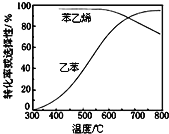
a.掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实__________。
b.控制反应温度为![]() 的理由是___________
的理由是___________
(4)在逆过程苯乙烯加氢制乙苯的操作中,如果氢气中混有![]() 和
和![]() 等杂质,会引起催化剂中毒,因此必须除去。在常温下,可以用银氨溶液来检测微量的
等杂质,会引起催化剂中毒,因此必须除去。在常温下,可以用银氨溶液来检测微量的![]() ,其原理与银镜反应相似,有银析出,写出银氨溶液与
,其原理与银镜反应相似,有银析出,写出银氨溶液与![]() 反应的离子方程式________________。
反应的离子方程式________________。
(5)苯乙烯废气在工业上常用电催化氧化处理,原理如图所示:
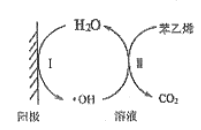
写出阳极电极反应式I为______________
【答案】+124 ![]()
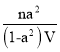 正反应气体分子数增加,水蒸气起稀释作用,相当于减压的效果 600℃,乙苯的转化率和苯乙烯的选择性均较高 2[Ag(NH3)2]OH+CO=(NH4)2CO3+2Ag↓+2NH3 H2O-e-=-OH+H+
正反应气体分子数增加,水蒸气起稀释作用,相当于减压的效果 600℃,乙苯的转化率和苯乙烯的选择性均较高 2[Ag(NH3)2]OH+CO=(NH4)2CO3+2Ag↓+2NH3 H2O-e-=-OH+H+
【解析】
(1)反应热=反应物总键能-生成物总能键能,由有机物的结构可知,应是-CH2CH3中总键能与-CH=CH2、H2总键能之差;该反应能够发生的原因是△H-T△S<0;
(2)用三行式分析各物质的平衡值,再根据平衡常数表达式K=c(苯乙酸)×c(H2)/c(乙苯)计算;
(3)a.保持压强不变,加入水蒸气,容器体积应增大,等效为降低压强,平衡向气体体积增大的方向移动;
b.600℃时乙苯的转化率与苯乙烯的选择性均较高;结合温度对乙苯转化率、苯乙烯选择性、温度对反应速率与催化剂的影响及消耗能量等,分析控制反应温度为600℃的理由;
(4)银氨溶液将CO氧化,生成银和碳酸根;
(5)由图I为阳极水失电子被氧化生成羟基和氢离子;
(1)反应热=反应物总键能-生成物总能键能,由有机物的结构可知,应是-CH2CH3中总键能与-CH=CH2、H2总键能之差,故△H=(5×412+348-3×412-612-436)kJ·mol-1=+124kJ·mol-1;
该反应能够发生的原因是△H-T△S<0,现△H>0,故△S>0;
(2)物质的量为n、体积为V的乙苯蒸气发生催化脱氢反应参加反应的乙苯为nα mol,则:
![]()
![]()
![]() +H2
+H2
开始(mol):n 0 0
转化(mol):nα nα nα
平衡(mol):n(1-α) nα nα
维持体系总压强p恒定,在温度T时,由PV=nRT可知,混合气体总浓度不变,设反应后的体积为V′,则
[n(1-α)+nα+nα]/V′=n/V,故V′=(1+α)V,则平衡常数K=c(苯乙酸)×c(H2)/c(乙苯),则K= ;
;
(3)a.正反应为气体分子数增大的反应,保持压强不变,加入水蒸气,容器体积应增大,等效为降低压强,平衡向正反应方向移动,提高乙苯的平衡转化率,
b.600℃时乙苯的转化率与苯乙烯的选择性均较高,温度过低,反应速率较慢,转化率较低,温度过高,选择性下降,高温下可能使催化剂失去活性,且消耗能量较大,故选择600℃左右;
(4)银氨溶液将CO氧化,生成银和碳酸根,银氨溶液与![]() 反应的离子方程式2[Ag(NH3)2]OH+CO=(NH4)2CO3+2Ag↓+2NH3;
反应的离子方程式2[Ag(NH3)2]OH+CO=(NH4)2CO3+2Ag↓+2NH3;
(5)由图I为阳极水失电子被氧化生成羟基和氢离子:H2O-e-=-OH+H+。