题目内容
【题目】Mn3O4是生产软磁铁氧体材料的主要原料。以硫酸工业的尾气联合制备化肥X和Mn3O4的工艺流程如下:
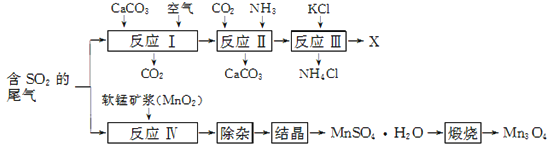
请回答下列问题:
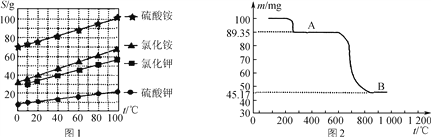
(1) 几种盐的溶解度见下如图。化肥X的化学式为________;为获得固体X,加入KCl溶液后需对混合溶液进行蒸发浓缩,当析出大量晶体后,应________(填操作名称),再洗涤、干燥晶体。
(2) 检验X样品是否含有氯化物杂质的实验操作是________。
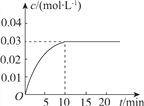
(3) 如图是隔绝空气条件煅烧MnSO4·H2O时剩余固体质量与温度的变化曲线,请写出A→B的化学方程式:____________________。
(4) 为了测定产品中Mn3O4的纯度,取2.500 g样品与浓盐酸共热(杂质不与盐酸反应),将产生的气体通入足量淀粉碘化钾溶液中,稀释至250 mL,从中取25.00 mL用0.100 0 mol·L-1 Na2S2O3标准溶液滴定至终点时,消耗20.00 mL标准溶液(2Na2S2O3 +I2===2NaI+Na2S4O6)。
① 样品与浓盐酸发生反应的离子方程式为________。
② 该样品的纯度为________。
【答案】 K2SO4 趁热过滤 取少量样品于试管中配成溶液,滴加过量Ba(NO3)2溶液,再取上层清液滴加硝酸酸化的AgNO3溶液,若无白色沉淀生成,则不含氯化物 3MnSO4![]() Mn3O4+SO2↑+2SO3↑ Mn3O4+8H++2Cl-
Mn3O4+SO2↑+2SO3↑ Mn3O4+8H++2Cl-![]() 3Mn2++Cl2↑+4H2O 91.6%
3Mn2++Cl2↑+4H2O 91.6%
【解析】(1) 根据图中几种盐的溶解度可知,X为溶解度最低的盐,是K2SO4;为获得固体K2SO4,加入KCl溶液后需对混合溶液进行蒸发浓缩,当析出大量晶体后,应 趁热过滤,再洗涤、干燥晶体。
(2) 检验K2SO4样品是否含有氯化物杂质,可取少量样品于试管中配成溶液,滴加过量Ba(NO3)2溶液,再取上层清液滴加硝酸酸化的AgNO3溶液,若无白色沉淀生成,则不含氯化物;
(3) 原MnSO4·H2O的质量为100mg,A点质量为89.35mg,减小的质量为100mg-89.35mg=10.65mg,而100mgMnSO4·H2O中水的质量为100mg×![]() ×100%=10.65mg,可知A为MnSO4,A中Mn元素的质量为89.35mg×
×100%=10.65mg,可知A为MnSO4,A中Mn元素的质量为89.35mg×![]() ×100%=32.54mg,B中氧元素的质量为45.17mg-32.54mg=12.63mg,则B中Mn:O=
×100%=32.54mg,B中氧元素的质量为45.17mg-32.54mg=12.63mg,则B中Mn:O=![]() :
:![]() =3:4,根据元素化合价的判断可知A分解生成B的反应为氧化还原反应,Mn元素化合价升高,则S化合价降低,还原产物为SO2,根据电子守恒或原子守恒可知A→B的化学方程式为3MnSO4
=3:4,根据元素化合价的判断可知A分解生成B的反应为氧化还原反应,Mn元素化合价升高,则S化合价降低,还原产物为SO2,根据电子守恒或原子守恒可知A→B的化学方程式为3MnSO4![]() Mn3O4+SO2↑+2SO3↑;
Mn3O4+SO2↑+2SO3↑;
(4) Mn3O4与浓盐酸混合加热生成氯气和氯化锰,发生反应的离子方程式为Mn3O4+8H++2Cl-![]() 3Mn2++Cl2↑+4H2O;根据:Mn3O4~~~~~Cl2~~~~~I2~~~~2Na2S2O3,Mn3O4的物质的量为0.1000mol·L-1×0.020L×
3Mn2++Cl2↑+4H2O;根据:Mn3O4~~~~~Cl2~~~~~I2~~~~2Na2S2O3,Mn3O4的物质的量为0.1000mol·L-1×0.020L×![]() =0.001mol,该样品Mn3O4的纯度为
=0.001mol,该样品Mn3O4的纯度为![]() ×100%=91.6%。
×100%=91.6%。