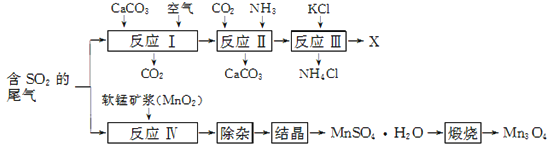
题目内容
【题目】向一容积为5L的恒容密闭容器内,充入0.2molCO和0.4molH2O,在一定条件下发生反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH>0。反应中CO2的浓度(c)随时间(t)的变化关系如图所示。
CO2(g)+H2(g) ΔH>0。反应中CO2的浓度(c)随时间(t)的变化关系如图所示。
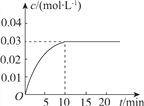
回答下列问题:
(1)下列叙述能判断该反应达到平衡状态的是________(填序号)。
①H2O的质量不再变化
②混合气体的总压强不再变化
③CO、H2O、CO2、H2的浓度都相等
④单位时间内生成amolCO,同时生成amolH2
(2)0~10min时段,反应速率v(H2)=________;反应达到平衡时,c(H2O)=________,CO的转化率为________。
【答案】 ①④ 0.003mol·L-1·min-1 0.05mol·L-1 75%
【解析】(1)①H2O的质量不再变化,说明正逆反应速率相等,达平衡状态,故正确;②两边气体计量数相等,混合气体的总压强一直不再变化,故错误;③达平衡时CO、H2O、CO2、H2的浓度不变,但不一定相等,故错误;④单位时间内生成amol CO等效于消耗amol H2,同时生成amol H2,说明正逆反应速率相等,达平衡状态,故正确;故选①④;
(2)0~10min时段,反应速率v(H2)=v(CO2)=![]() =0.003mol(Lmin)-1;反应达到平衡时,
=0.003mol(Lmin)-1;反应达到平衡时,
CO(g)+H2O(g)![]() CO2(g)+H2 (g)
CO2(g)+H2 (g)
起始量浓度:0.04 0.08 0 0
变化量: 0.03 0.03 0.03 0.03
平衡量: 0.01 0.05 0.03 0.03
c(H2O)=0.05 mol(Lmin)-1,CO的转化率为:![]() ×100%=75%。
×100%=75%。

练习册系列答案
 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案
相关题目