题目内容
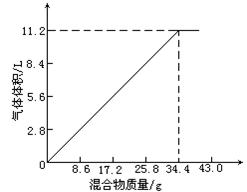
在100mL NaOH溶液中加入NH4NO3和(NH4)2SO4的固体混合物,加热充分反应,如图表示加入的混合物质量与产生的气体体积(标准状况)的关系。试计算
(1) NaOH溶液的物质的量浓度。
(2)当NaOH溶液的体积为140mL,固体混合物的质量是51.6g时,充分反应后,生成气体的体积在标准状况下为多少L。
(3)当NaOH溶液的体积为180mL,固体混合物的质量仍为51.6g时,充分反应后,生成气体的体积在标准状况下为多少L?

(1) NaOH溶液的物质的量浓度。
(2)当NaOH溶液的体积为140mL,固体混合物的质量是51.6g时,充分反应后,生成气体的体积在标准状况下为多少L。
(3)当NaOH溶液的体积为180mL,固体混合物的质量仍为51.6g时,充分反应后,生成气体的体积在标准状况下为多少L?
(1)从图上看出34.4g混合物和100mL NaOH溶液恰好完全反应
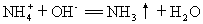
生成11.2L NH3,消耗的NaOH的物质的量为
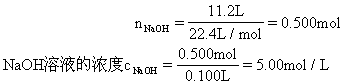
(2)由于34.4g固体恰好跟 100mL NaOH溶液完全反应,则跟51.6g固体反应时需要的NaOH溶液体积为
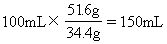
所以,140mL NaOH溶液是不足量的,计算NH3的体积应以它为准。生成的NH3的体积为
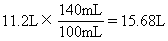
(3)由第(2)小题得知,51.6g铵盐固体混合物完全反应时需要150mL NaOH溶液,题设NaOH溶液体积为180mL,所以铵盐混合物是不足量的。生成NH3的体积为

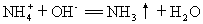
生成11.2L NH3,消耗的NaOH的物质的量为
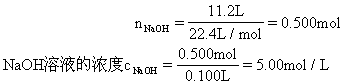
(2)由于34.4g固体恰好跟 100mL NaOH溶液完全反应,则跟51.6g固体反应时需要的NaOH溶液体积为
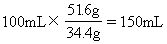
所以,140mL NaOH溶液是不足量的,计算NH3的体积应以它为准。生成的NH3的体积为
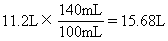
(3)由第(2)小题得知,51.6g铵盐固体混合物完全反应时需要150mL NaOH溶液,题设NaOH溶液体积为180mL,所以铵盐混合物是不足量的。生成NH3的体积为

(1)由图中折线所对应的纵、横坐标得知,对于100mL NaOH溶液而言,随着铵盐的加入量增加,放出的NH3的体积也增大;但当铵盐的加入量超过34.4g以后,NH3的体积不再变化,说明100mL NaOH溶液跟34.4g铵盐恰好完全反应。
(2)为计算140mL NaOH溶液跟51.6g固体铵盐混合物反应后生成的NH3的体积,首先应判断这两种作用物中何者为过量试剂,具体计算时可根据第(1)小题中的量按比例计算。
(3)题计算方法与第(2)题相仿。
(2)为计算140mL NaOH溶液跟51.6g固体铵盐混合物反应后生成的NH3的体积,首先应判断这两种作用物中何者为过量试剂,具体计算时可根据第(1)小题中的量按比例计算。
(3)题计算方法与第(2)题相仿。

练习册系列答案
相关题目
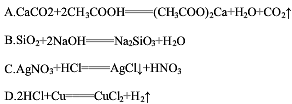


 金属,硬度很大
金属,硬度很大