题目内容
15.对于可逆反应2SO2(g)+O2(g)?2SO3(g)△H<0,下列叙述正确的是( )| A. | 单位时间内生成2molSO3的同时消耗了1molO2,则反应到达平衡状态 | |
| B. | 升高温度反应速率增大,由于该反应是放热反应,V(逆)小于V(正),所以反应达到平衡的时间将延长 | |
| C. | 保持温度和密闭体系体积不变,起始加入2molSO2和1molO2,平衡后加入2molSO2和1molO2,重到达平衡时SO2的体积分数减小 | |
| D. | 该反应的化学平衡常数表达式为K=$\frac{{C}_{(S{O}_{2})}^{2}•{C}_{{(O}_{2})}}{{C}_{(S{O}_{3})}^{2}}$ |
分析 A.生成2molSO3的同时消耗了1molO2都是正反应,无法判断正逆反应速率是否相等;
B.升高温度后反应速率增大,则达到平衡的时间减小;升高温度后平衡向着逆向移动,则V(逆)>V(正);
C.温度和体积不变条件下,起始加入2molSO2和1molO2,平衡后加入2molSO2和1molO2,重到达平衡时相当于增大了压强,平衡向着正向移动,二氧化硫的体积分数减小;
D.根据平衡常数的概念及表达式进行判断.
解答 解:A.单位时间内生成2molSO3的同时消耗了1molO2,表示的都是正反应,无法判断正逆反应速率是否相等,则无法判断是否达到平衡状态,故A错误;
B.升高温度反应速率增大,则达到平衡的时间减小;由于该反应是放热反应,平衡向着逆向移动,V(逆)大于V(正),故B错误;
C.温度和容器的体积不变条件下,起始加入2molSO2和1molO2,平衡后加入2molSO2和1molO2,重新达平衡时相当于在增大了压强,平衡向着正向移动,则达到平衡时二氧化硫的体积分数减小,故C正确;
D.反应2SO2(g)+O2(g)?2SO3(g)的平衡常数表达式为:K=$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})•c({O}_{2})}$,故D错误;
故选C.
点评 本题考查了化学平衡及其影响因素、化学平衡的判断,题目难度中等,明确化学平衡的影响因素为解答关键,注意掌握化学平衡状态的特征及判断方法,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
6.下列离子方程式不正确的是( )
| A. | FeSO4酸性溶液暴露在空气中:4Fe2++O2+4H+═4Fe3++2H2O | |
| B. | 向碳酸氢钙溶液中加入过量氢氧化钠 Ca2++2HCO3-+2OH-═CaCO3↓+2H2O+CO32- | |
| C. | 用铁棒作阴极、炭棒作阳极电解饱和氯化钠溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2OH- | |
| D. | 向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO42-完全沉淀:2Ba2++Al3++2SO42-+4OH-═AlO2-+2BaSO4↓+2H2O |
3.密闭容器中进行的反应SO2(g)+O3(g)?SO3(g)+O2(g)温度保持不变,下列说法中正确的是( )
| A. | 增加SO2的浓度,正反应速率先增大,后逐渐减小最后保持不变 | |
| B. | 增加O2的浓度,正反应速率逐渐增大 | |
| C. | 增加SO2的浓度,平衡常数增大 | |
| D. | 若平衡时SO2的浓度比原来大,则平衡常数增大 |
10.下列说法正确的是( )
| A. | 在放热反应中,旧键断裂需要的能量比新键形成放出的能量多 | |
| B. | 伴有能量变化的物质变化都是化学变化 | |
| C. | 在一个确定的化学反应中,反应物的总能量与生成物的总能量一定不同 | |
| D. | 一个化学反应的能量变化只与反应物的用量有关,与各物质的状态无关 |
20.某强酸性溶液X中可能含有Fe2+、A13+、NH4+、CO32ˉ、SO32ˉ、SO42ˉ、C1ˉ中的若干种,现取X溶液进行连续实验,实验过程及产物如下:下列说法不正确的是( )


| A. | 气体A是NO | |
| B. | X中不能确定的离子是 A13+和C1ˉ | |
| C. | 溶液E和气体F能发生化学反应 | |
| D. | X中肯定存在Fe2+、A13+、NH4+、SO42ˉ |
7.用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 标准状况下,11.2LCCl4中含有分子的数目为0.5NA | |
| B. | 标准状况下,2.24LCl2通入水中生成NA个HClO | |
| C. | 1.6gO2与O3组成的混合物中所含O原子数为0.1NA | |
| D. | 25℃时pH=13的NaOH溶液中含有OH-的数目为0.1NA |
4.能发生加成反应,也能发生取代反应,能使酸性高锰酸钾溶液褪色,同时也能使溴水因反应而褪色的( )
| A. | 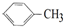 | B. | C6H12 | C. |  | D. |  |
5.下列物质电离出的Cl-数目与2molNaCl电离出的Cl-数目相同的是( )
| A. | 1mol MgCl2 | B. | 2mol KClO3 | C. | 1 mol AlCl3 | D. | 1.5 mol CaCl2 |