题目内容
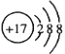
【题目】某烃经分析测得碳的质量分数为85.71%,质谱图显示,其质荷比为84;该烃的核磁共振氢谱如图所示.则该烃为( ) 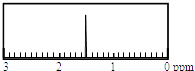
A.HCHO
B.![]()
C.![]()
D.![]()
【答案】B
【解析】解:碳的质量分数为85.71%,则氢元素的质量分数为1﹣85.71%=14.29%,故N(C):N(H)= ![]() :
: ![]() =1:2,故该烃的最简式为CH2;
=1:2,故该烃的最简式为CH2;
分子离子峰的质荷比为84,该烃的相对分子质量为84,令组成为(CH2)n,则14n=84,解得n=6,故该分子式为C6H12;
由该烃的核磁共振氢谱可知,核磁共振氢谱只有1个峰,分子中只有1种H原子,故该烃为(CH3)2C=C(CH3)2或 ![]() ;
;
故选:B.
根据碳元素的质量分数计算出氢元素的质量分数,质量分数与摩尔质量的比值相当于原子的物质的量,据此确定原子个数比值,求出最简式;分子离子峰的质荷比为84,该烃的相对分子质量为84,根据相对分子质量结合最简式计算出该有机物的化学式;由该烃的核磁共振氢谱可知,核磁共振氢谱只有1个峰,分子中只有1种H原子,结合分子式书写结构简式.

练习册系列答案
相关题目