题目内容
【题目】现用17.10 g Ba(OH)2固体配成250mL溶液待用。利用上述所配制的溶液测定Na2SO4和NaHSO4混合物的组成。(计算结果保留三位有效数字)
(1)配制的Ba(OH)2溶液的物质的量浓度_____mol·Lˉ1。
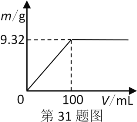
(2)现称取5.24g该固体混合物,配成100mL溶液。逐滴加入上述Ba(OH)2溶液,产生的沉淀质量与加入Ba(OH)2溶液体积的关系如图。当产生沉淀最多时,混合溶液中c(OH-)为________mol·L-1(忽略体积变化)。
(3)混合物中n[Na2SO4]∶n(NaHSO4)为_________。
【答案】0.4 0.3 1:1
【解析】
![]() ,
,![]() 。
。
(1)配制的Ba(OH)2溶液的物质的量浓度为0.400 mol·Lˉ1;
(2)![]() ;所以加入的
;所以加入的![]() ;
;
假设混合固体中有x mol的Na2SO4,2y mol的NaHSO4,
则生成硫酸钡沉淀的n可表示为x+y=0.04 ①,
混合固体的总质量可表示为142x+120×2y=5.24 ②,
联立①②可解出n(Na2SO4)=0.02mol,n(NaHSO4)=0.02mol,
所以当产生沉淀最多时,混合溶液中c(OH-)=![]() 0.3mol·L-1。
0.3mol·L-1。
(3)由第(2)问可知,两固体混合物的物质的量之比为1:1。

练习册系列答案
相关题目


