题目内容
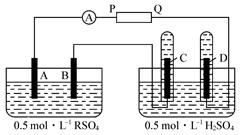
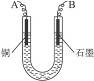
(9分)用Cu为电极,电解浓度均为2 mol·L-1的AgNO3和Cu(NO3)2的混合溶液500 mL,一段时间后,阴极上析出1.6 g Cu时,不考虑溶液体积变化:
(1)电路中流过_________mol 电子;
(2)溶液中c(Cu2+)=_________mol·L-1;
(3)阳极Cu消耗了_________g。
(1)电路中流过_________mol 电子;
(2)溶液中c(Cu2+)=_________mol·L-1;
(3)阳极Cu消耗了_________g。
(1)1.05(3分) (2)3(3分) (3)33.6 (3分)
阴极析出1.6 g Cu时,溶液中的Ag+已完全析出。故转移的电子为:n(e-)="2" mol·
L-1×0.5 L+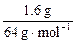 ×2="1.05" mol。
×2="1.05" mol。
此时阳极应消耗m(Cu)=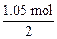 ×64 g·mol-1="33.6" g,c(Cu2+)=(2 mol·L-1×0.5 L+
×64 g·mol-1="33.6" g,c(Cu2+)=(2 mol·L-1×0.5 L+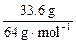 -
-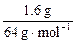 )/0.5 L="3" mol·L-1。
)/0.5 L="3" mol·L-1。
L-1×0.5 L+
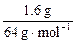 ×2="1.05" mol。
×2="1.05" mol。此时阳极应消耗m(Cu)=
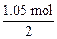 ×64 g·mol-1="33.6" g,c(Cu2+)=(2 mol·L-1×0.5 L+
×64 g·mol-1="33.6" g,c(Cu2+)=(2 mol·L-1×0.5 L+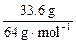 -
-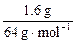 )/0.5 L="3" mol·L-1。
)/0.5 L="3" mol·L-1。
练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目