题目内容
19.完全燃烧一定质量的无水乙醇,放出的热量为Q,已知为了完全吸收生成的二氧化碳气体,消耗掉8mol/L的氢氧化钠溶液50mL,则1mol无水乙醇的燃烧放出的热量不可能是( )| A. | 10Q | B. | 5Q~10Q | C. | 3Q | D. | 8Q |
分析 据CO2与NaOH溶液反应,利用极限法计算出CO2的物质的量范围,进而计算出乙醇的物质的量范围,根据乙醇的物质的量和热量的关系计算出1mol乙醇完全燃烧生成水放出的热量即可.
解答 解:n(NaOH)=0.05L×8mol/L=0.4mol,则由CO2~2NaOH~Na2CO3,可知n(CO2)=0.2mol,则n(C2H6O)=$\frac{1}{2}$×n(CO2)=0.1mol,放出的热量为Q,所以1mol乙醇完全燃烧放出的热量为10Q,由CO2~NaOH~NaHCO3可知,n(CO2)=0.4mol,则n(C2H6O)=$\frac{1}{2}$×n(CO2)=0.2mol,放出的热量为Q,所以1mol乙醇完全燃烧放出的热量为5Q,若二氧化碳和氢氧化钠反应生成碳酸氢钠和碳酸钠的化合物,则乙醇的燃烧热在5Q~10Q之间,所以C不符合;
故选C.
点评 本题考查了化学反应极值分析计算,反应燃烧热概念的分析应用,掌握概念和计算方法是解题关键,题目难度中等.

练习册系列答案
相关题目
9.己知在标准状况下6.72L 某气体质量为8.4g,则该气体可能为( )
| A. | NH3 | B. | N02 | C. | CO2 | D. | CO |
10.下列说法正确的是( )
| A. | SO2溶于水,其水溶液能导电,说明SO2是电解质 | |
| B. | 向氨水中加入氢氧化钠或氯化铵都能使氨水的电离平衡逆向移动,一水合氨的电离常数减小 | |
| C. | 向氯水中加入Na2CO3可使溶液中c(HClO)增大 | |
| D. | 室温下,将浓度为0.1 mol•L-1HF溶液加水稀释,其电离平衡常数和$\frac{c({H}^{+})}{c(HF)}$均不变 |
14.用NA表示阿伏加德罗常数,下列说法中,正确的是( )
| A. | 常温常压下,3.0 g乙烷中含有的碳氢键数为0.6NA | |
| B. | 标准状况下,22.4 L C2H5OH中含有的氢原子数为6 NA | |
| C. | 常温常压下,92 g的 NO2和N2O4混合气体含有的分子数为 6 NA | |
| D. | 标准状况下,由Na2O2制得11.2 L O2,反应转移的电子数为0.5 NA |
4.如图表示不同温度下水溶液中c(H+)与c(OH-)的关系,下列判断正确的是( )
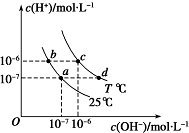

| A. | 两条曲线上任意点均有c(H+)×c (OH-)=Kw | |
| B. | T<25 | |
| C. | b点和c点pH均为6,溶液呈酸性 | |
| D. | 只采用升温的方式,可由a点变成d点 |
8.下列反应中,属于氧化还原反应的是( )
| A. | 氢氧化铝受热分解 | |
| B. | 氧化铜与硝酸反应 | |
| C. | 实验室中用高锰酸钾加热分解制取 氧气 | |
| D. | 实验室中用氯化铵固体与氢氧化钙固体制取氨气 |