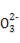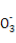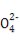题目内容
25 ℃时,某溶液中由水电离出的H+的浓度为1×10-a mol/L,以下说法正确的是( )
A.a>7时,水的电离一定受到促进
B.a<7时,水的电离一定受到抑制
C.a>7时,溶液的pH为a或14-a
D.a<7时,溶液的pH一定为a
C
【解析】常温下水的离子积是1×10-14,由水电离出来的H+的浓度为1×10-7 mol/L,如果a>7肯定是水的电离受到了抑制,该溶液可能是酸溶液也可能是碱溶液。如果a<7,水的电离一定受到促进,是盐的水解起到了作用。A、B项正好答反,所以A、B都错。C选项,当a>7时,如果是碱溶液,则此时溶液中所有的H+都是由水电离产生的,此时溶液的pH=a,如果是酸溶液,则此时溶液中所有的OH-都是由水电离产生的,此时溶液的pOH=a,pH=14-a。D选项中,当a<7时,如果溶液呈酸性,溶液中的氢离子都是由水电离产生的,故有pH=a,如果溶液呈碱性,则溶液中所有的OH-都是由水电离产生的,得到pOH=a,pH=14-a。

一定温度下的难溶电解质AmBn在水溶液中达到沉淀溶解平衡时,其平衡常数Ksp=cm(An+)×cn(Bm-),称为难溶电解质的溶度积。25 ℃时,在AgCl的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液,观察到的现象是先出现黄色沉淀,最后生成黑色沉淀。已知有关物质的颜色和溶度积如下:
物质 | AgCl | AgI | Ag2S |
颜色 | 白 | 黄 | 黑 |
Ksp(25 ℃) | 1.8×10-10 | 1.5×10-16 | 1.8×10-50 |
下列叙述不正确的是( )
A.溶度积小的沉淀可以转化为溶度积更小的沉淀
B.若先加入Na2S溶液,再加入KI溶液,则无黄色沉淀产生
C.25 ℃时,饱和AgCl、AgI、Ag2S溶液中所含Ag+的浓度相同
D.25 ℃时,AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶度积相同