题目内容
26.U、V、W、X、Y、Z是原子序数依次增大的六种常见元素。Y的单质在W2中燃烧的产物可使品红溶液褪色。Z和W元素形成的化合物Z3W4具有磁性。U的单质在W2中燃烧可生成UW和UW2两种气体。X的单质是一种金属,该金属在UW2中剧烈燃烧生成黑、白两种固体。请回答下列问题:
(1)V的单质分子的结构式为 ;XW的电子式为 ;Z元素在周期表中的位置是 。
(2)U元素形成的同素异形体的晶体类型可能是(填序号) 。
①原子晶体 ②离子晶体 ③分子晶体 ④金属晶体
(3)U、V、W形成的10电子氢化物中,U、V的氢化物沸点较低的是(写化学式)
;V、W的氢化物分子结合H+能力较强的是(写化学式) ;用一个离子方程式加以证明 。
(4)YW2气体通入BaCl2和HNO3的混合溶液,生成白色沉淀和无色气体VW,有关反应的离子方程式为 ,由此可知VW和YW2还原性较强的是(写化学式) 。
(1)N≡N ![]() 第4周期,第Ⅷ族
第4周期,第Ⅷ族
(2)① ③
(3)CH4 NH3
NH3+H3O+=![]() +H2O
+H2O
(4)3SO2+2![]() +3Ba2++2H2O=3BaSO4↓+2NO+4H+ SO2
+3Ba2++2H2O=3BaSO4↓+2NO+4H+ SO2
解析:本题涉及物质结构、元素化合物知识、离子反应等内容,综合考查考生综合运用知识的能力。由Y的单质在W2中燃烧的产物可使品红褪色,可知Y为硫,W为氧元素。由氧化物Z3O4具有磁性可知Z为铁,由于U的原子序数小于氧,且在O2中燃烧生成UO和UW2两种气体,所以U为碳元素。则V元素必为氮,又由金属单质X在CO2中燃烧生成黑、白两种固体,可知X为镁元素。在六种元素皆已确定的条件下,题目所涉及的问题便可解出。

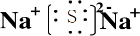

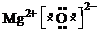
 有U、V、W、X、Y、Z、T七种前四周期元素,它们的原子序数依次增大,其相关信息如下表:
有U、V、W、X、Y、Z、T七种前四周期元素,它们的原子序数依次增大,其相关信息如下表: